磷脂酶D交联聚集体的制备及其酶学性能研究
酶催化因其较高的催化活性、特异性和温和的反应条件而被广泛应用于医药、食品加工、化学合成和生物降解等领域。其中,磷脂酶D(EC 3.1.4.4 phospholipase D,PLD)可以催化水解磷脂分子并生成磷脂酸和有机碱。在一定条件下PLD还能够催化甘油、丝氨酸、胆碱、醇类物质等含羟基的化合物与磷脂酰基团结合,形成新的磷脂[1-2]。PLD催化作用反应式如图1所示。虽然PLD存在于各种微生物、植物、动物中,但来源于微生物的PLD具有对底物耐受性强、对碱基交换反应催化活性高的特点[3]。
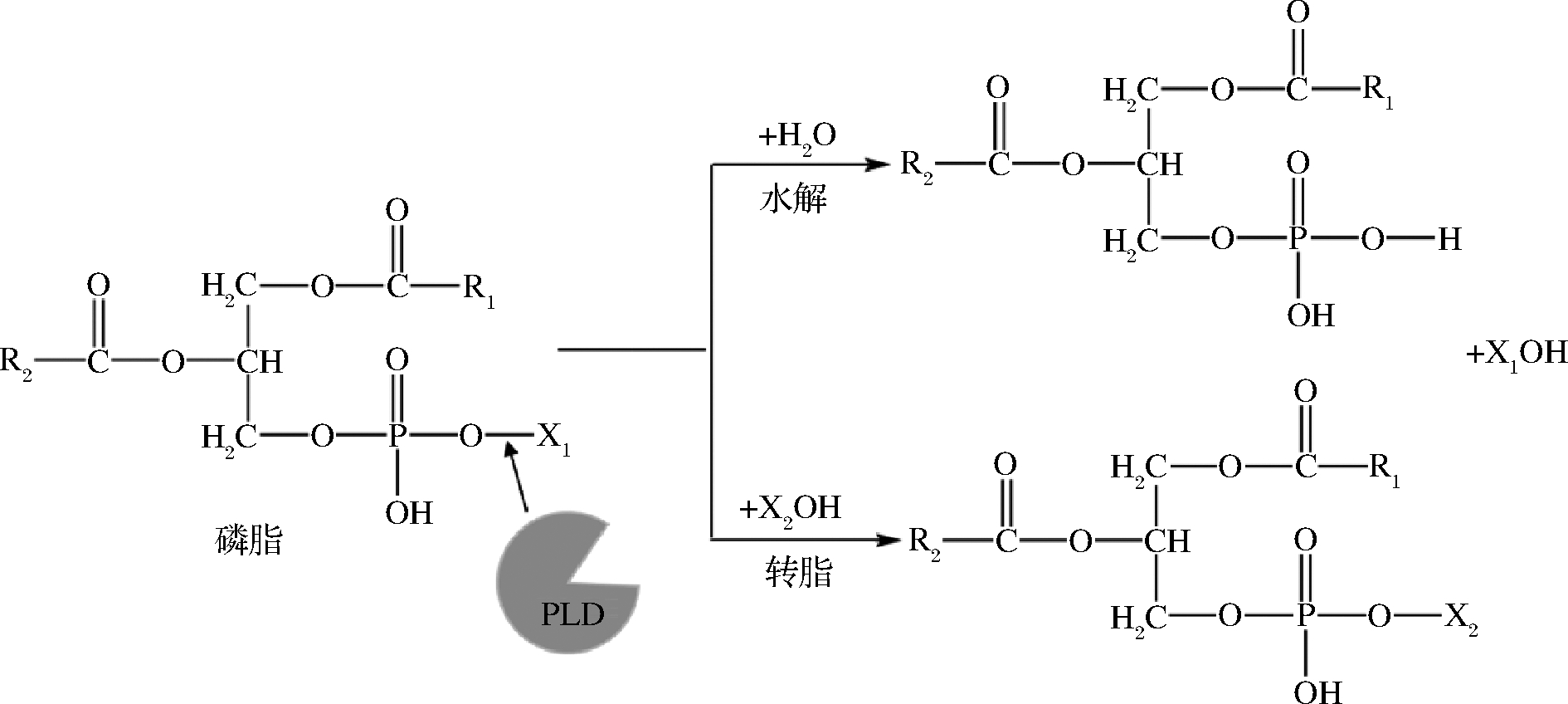
图1 PLD的催化水解和转磷脂酰化反应的作用机理
Fig.1 Reaction mechanism of PLD-catalyzed hydrolysis and transphosphatidylation
天然PLD存在成本较高、操作稳定性低、回收再利用困难等缺陷,严重制约了其在工业上的应用。酶固定化是解决上述问题的有效手段之一。近年来,关于PLD固定化的研究已有少量报道。MAO等[4]以环氧树脂交联法对Bacillus subtilis来源的PLD进行固定化,但所得固定化酶底物转化率和重复使用性都较差。通过对载体进行改进,得到了以介孔SiO2/聚合物纳米复合材料[5]、氨基功能化的中空介孔SiO2立方体[6]、分层空隙聚合物修饰的环氧树脂[7]为载体的PLD固定化酶,具有良好的操作稳定性,且材料新颖,但载体成本较高,难于进行大规模的工业化生产。上述PLD固定化酶中含有大量的非催化载体,降低了固定化酶的单位体积活性和催化效率,而且对于惰性基质需要对其进行化学修饰后,才能与PLD进行共价偶联,制作成本较高[8-9]。因此,寻求一种操作简单、成本经济、酶活力回收率高且操作稳定性良好的PLD固定化方法受到越来越多的关注。
交联酶聚集体(cross-linked enzyme aggregates,CLEAs)是一种无载体固定化技术。首先通过水溶性有机溶剂、中性盐溶液或非离子型聚合物等沉淀剂将游离酶沉淀,然后加入双功能试剂交联得到不溶于水的酶聚集体。由于酶的沉淀过程中存在的非共价作用力较弱,不会破坏蛋白质的三维结构,从而保留了酶的大部分活性[10-11]。与有载体固定化相比,CLEAs具有制备过程简单、对酶纯度要求低、单位体积活性高、特异性好、适用范围广泛等优点,且具有优异的有机溶剂和高温高压耐受性,表现出良好的贮藏稳定性和实际操作稳定性[10,12]。另外,CLEAs自身酶负载量高,在制备过程中活性损失较小,有效避免了固体载体引入时可能造成的酶失活[13]。近年来CLEAs技术已用于固定多种不同的酶,比如脂肪酶、漆酶、α-淀粉酶等,得到的CLEAs的稳定性和催化性能都得到了不同程度的提高[14-16]。但目前尚未有利用CLEAs技术固定化PLD及其酶学性能研究的报道。因此,本研究拟开发一种高效的PLD-CLEAs的制备方法,并对所得固定化酶PLD-CLEAs的催化性能和酶学性质进行全面的评估。首先考察沉淀和交联条件对酶活性回收率的影响,对PLD-CLEAs的酶学性质(催化活性、热稳定性、最适温度和pH值、重复使用性)进行研究,并与游离酶进行探讨和比较,以期得到一种高效的PLD固定化酶,为其工业化应用奠定基础。
1 材料与方法
1.1 材料与试剂
菌种:枯草芽胞杆菌(Bacillus subtilis)WB600,由本实验室保藏。
试剂:胆碱氧化酶、过氧化物酶,Sigma-Aldrich;胰蛋白胨、酵母粉、琼脂粉、卡那霉素,北京索莱宝科技有限公司;卵磷脂(phosphatidylcholine,PC),上海源叶生物科技有限公司;硫酸铵、戊二醛、TritonX-100、MnCl2、NaCl,上海麦克林生化科技有限公司;三羟甲基氨基甲烷(Tris)、甘氨酸、NaOH,北京奥博星生物技术有限责任公司公司;乙腈、乙醇、乙醚、盐酸,赛默飞世尔科技(中国)有限公司。
1.2 仪器与设备
SYC-A水浴恒温振荡器,上海新苗医疗器械制造有限公司;电子天平,梅特勒-托利多仪器(上海)有限公司;Centrifuge 5418小型高速离心机、Heto Drywinner冷冻干燥机,赛默飞世尔科技(中国)有限公司;ZXGP-B2080台式电热恒温培养箱,上海智城分析仪器制造有限公司;Multiskan Spectrum酶标仪、FEI Apreo扫描电子显微镜美国Thermo Fisher Scientific公司。
1.3 实验方法
1.3.1 PLD的制备
取1 μL保藏于本实验室-80 ℃冰箱的枯草芽胞杆菌,采用分段划线法接种于LB固体培养基上,于37 ℃恒温培养箱中倒置培养12 h,获得单菌落。将单菌落转移至含有50 μg/mL卡那霉素的LB液体培养基(5 mL),置于恒温空气浴摇床中37 ℃、220 r/min培养12 h;取5 mL菌液转接入含有50 μg/mL卡那霉素的250 mL培养液中,37 ℃,220 r/min培养48 h后,将发酵液在10 000 r/min、4 ℃离心10 min,上清液即为PLD粗酶液,冻干后备用。
1.3.2 PLD-CLEAs的制备及优化
1.3.2.1 沉淀剂种类和浓度对PLD-CLEAs酶活性的影响
以PLD-CLEAs的酶活性回收率作为优化指标,探讨不同沉淀剂种类和浓度对PLD活性的影响。取1 mL 100 mg/mL的游离PLD酶液,分别加入到4 mL不同体积分数的预冷有机溶剂(乙醇和乙腈)和不同饱和度硫酸铵溶液中,PLD的质量浓度为100 mg/mL,4 ℃搅拌沉淀30 min。离心分离除去上清液,将沉淀用100 mmol/L Tris-HCl缓冲液(pH 8.0)复溶后测定PLD的活性。
1.3.2.2 交联剂浓度对PLD-CLEAs酶活性的影响
以PLD-CLEAs的酶活性回收率作为优化指标,探讨不同戊二醛浓度对PLD-CLEAs活性的影响。取1 mL 100 mg/mL的游离PLD酶液,与4 mL硫酸铵溶液混合,硫酸铵饱和度为60%,于4 ℃搅拌沉淀30 min。随后分别加入不同质量分数的戊二醛(0.025%、0.050%、0.075%、0.100%、0.125%、0.150%),在4 ℃下搅拌交联1 h。反应结束后8 000 r/min离心分离5 min,收集沉淀物,用100 mmol/L Tris-HCl缓冲液(pH 8.0)反复洗涤,获得PLD-CLEAs并测定其活性。
1.3.2.3 交联时间对PLD-CLEAs酶活性的影响
以PLD-CLEAs的酶活性回收率作为优化指标,探讨不同交联时间对PLD-CLEAs活性的影响。取适量冻干的PLD酶粉,与4 mL硫酸铵溶液(饱和度60%)混合,PLD的质量浓度为100 mg/mL,于4 ℃搅拌沉淀30 min。随后加入质量分数为0.125%的戊二醛,在4 ℃下分别搅拌反应0.5、1.0、1.5、2.0、2.5、3.0 h。反应结束后,离心分离收集沉淀物,用100 mmol/L Tris-HCl缓冲液(pH 8.0)反复洗涤,获得PLD-CLEAs并测定其活性。
1.3.3 酶活力测定
PLD活性的测定参照HUANG等[17]的方法稍作改进。以PC为底物,将一定量的PLD加入到含有0.23 mol/L MnCl2的Tris-HCl缓冲液(100 mmol/L,pH 8.0)中与底物溶液(4 mg/mL PC,乙醚8%,0.9 mol/L TritonX-100)充分混合,在45 ℃、200 r/min反应45 min后,煮沸5 min终止反应。反应液于室温条件下冷却后,取300 μL与500 μL胆碱显色液(胆碱氧化酶0.5 U/mL,过氧化物酶1 U/mL,4-安替比林0.5 mg/mL,苯酚0.25 mg/mL)混合,37 ℃保温30 min进行显色,使用酶标仪测定反应产物在500 nm处的吸光值。根据氯化胆碱显色后在500 nm处的标准曲线计算反应体系中胆碱的物质的量。一个酶活力单位(U)定义为:测试条件下1 min水解PC释放1 μmol胆碱所需的PLD的量。
固定化酶活性回收率计算如公式(1)所示:
酶活性回收率![]()
(1)
1.3.4 PLD-CLEAs的酶学性质
1.3.4.1 热稳定性
首先测定了不同酶制剂在高温(50 ℃)下的热稳定性。用Tris-HCl缓冲液(100 mmol/L,pH 8.0)配制相同浓度的游离和固定化酶溶液,将酶溶液置于50 ℃恒温水浴振荡器中保温,200 r/min热处理不同时间(0.5~6 h),按照1.3.3的方法测定每个时间点的酶活性。以酶液0 h时的催化活性为标准,将其活性定义为100%。
1.3.4.2 最适温度的测定
通过在不同温度条件下测定酶活力,确定固定化酶的最适反应温度。将游离和固定化酶溶液分别置于25、35、45、55、65 ℃下进行反应,不改变测定酶活力其他条件,对PLD和PLD-CLEAs的酶活力进行测定。
1.3.4.3 最适pH的测定
将游离和固定化酶溶液置于不同pH的缓冲溶液体系(100 mmol/L,pH 5.0~10.0)中,底物溶液pH也对应相应的反应pH值,对PLD和PLD-CLEAs的酶活力进行测定。所使用的缓冲溶液分别是柠檬酸-柠檬酸钠缓冲液(pH 5.0~6.0)、Na2HPO4-NaH2PO4缓冲液(pH 7.0~8.0)、Tris-HCl缓冲液(pH 9.0)和甘氨酸-NaOH缓冲液(pH 10.0)。
1.3.4.4 固定化酶重复使用性研究
配制一定浓度的固定化酶溶液,在最适反应条件下以PC为底物测定其在500 nm处的吸光值,计算PLD-CLEAs的活性。将反应溶液离心分离去上清液,用100 mmol/L的Tris-HCl缓冲液(pH 8.0)反复洗涤,以除去未反应的底物和产物;随后将离心洗涤后的固定化酶重新分散于缓冲液中,加入新的底物进行下一次的反应,如此重复10次。连续测定固定化酶在循环多次后的剩余酶活力,第1次使用时的酶活力定义为100%。
2 结果与分析
2.1 PLD游离酶的制备
PLD粗酶液的SDS-PAGE分析如图2所示,在分子质量约为60 kDa处,观察到明显的蛋白条带,即为目的蛋白PLD。

M-蛋白质标准;1-PLD发酵上清液
图2 PLD的SDS-PAGE分析
Fig.2 SDS-PAGE analysis of the phospholipase D
2.2 PLD-CLEAs的制备与优化
CLEAs的制备主要包括酶分子的沉淀和酶聚集体的交联,首先将溶解状态的酶利用沉淀剂进行物理沉淀形成酶聚集体,再加入交联剂使之与酶发生交联反应形成不溶的CLEAs。其中沉淀剂的种类和浓度、交联剂的浓度和交联反应时间均对CLEAs的制备和酶学特性有重要影响。
沉淀是制备CLEAs的第1步。常用的沉淀剂主要包括非离子型聚合物、水溶性有机溶剂和中性盐。为考察沉淀剂种类和浓度对酶沉淀过程中活性的影响,分别采用不同浓度的乙腈、乙醇、硫酸铵作为沉淀剂对PLD进行沉淀实验,随后用Tris-HCl缓冲液(pH 8.0)对所得聚集体进行复溶,测定溶解后的酶活力,并以未处理的PLD的酶活力为100%进行计算,结果如图3。随着沉淀剂浓度的增加,复溶后聚集体的酶活力回收呈现先升高后降低的趋势,但峰值出现的阶段有所变化。对于乙腈和乙醇,分别在体积分数60%和70%时的酶活力回收率最高,为40.6%和59.2%。但所有浓度条件下的酶活力均低于初始酶活力的60%。酶的失活可能是由于有机溶剂与酶的非极性残基之间的疏水相互作用而引起的构象变化所导致的[18]。当硫酸铵饱和度为60%~80%时,其酶活力均高于PLD的初始酶活力,且浓度为60%时,酶活力回收率达到最大值,为132.5%。研究表明,当硫酸铵饱和度较高(≥60%)时,会诱导酶分子形成一种高活化构象,使酶分子获得较高的活性,这种变化称为超活化[19-20]。因此,选取饱和度为60%的硫酸铵作为沉淀剂。
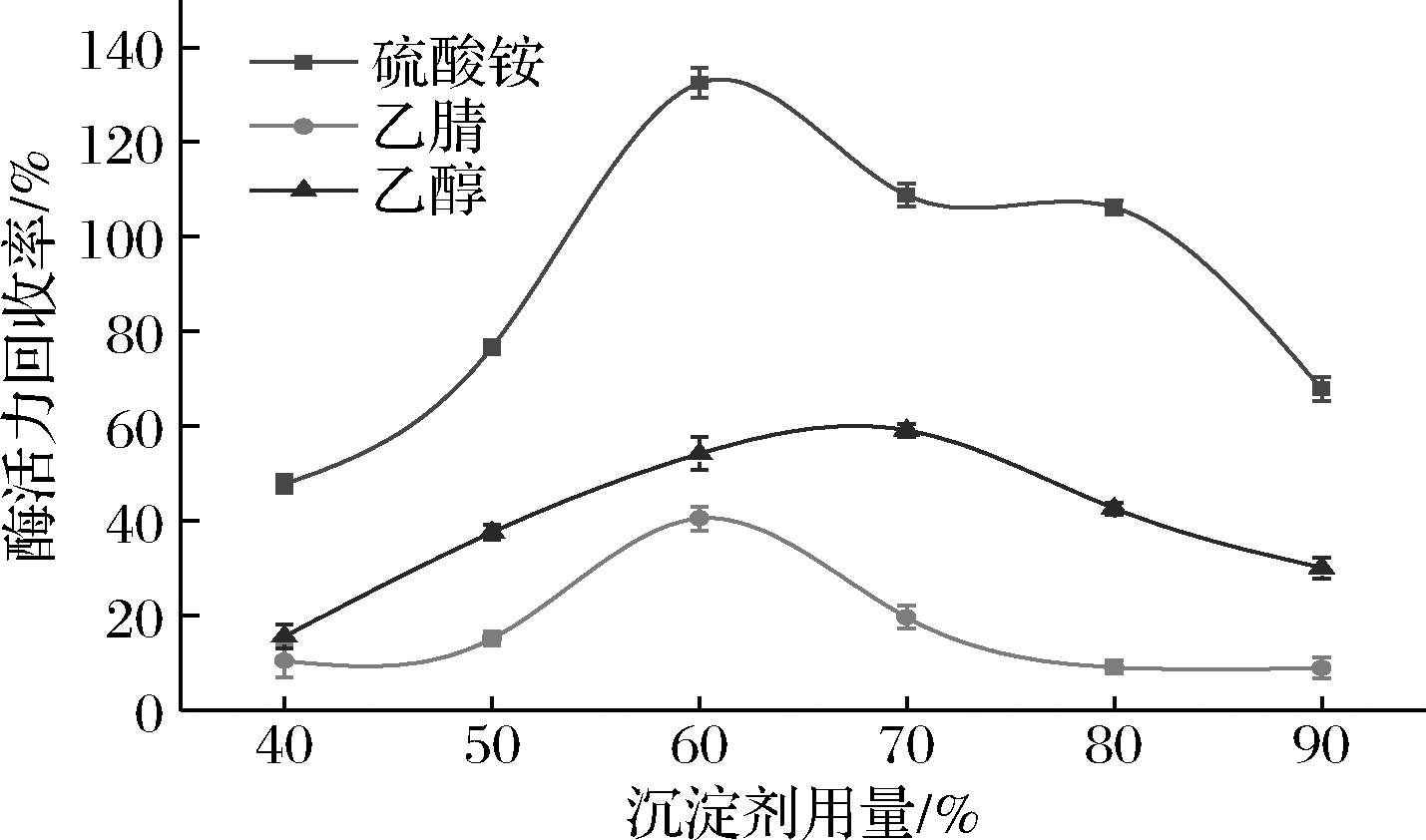
图3 沉淀剂的种类和浓度对PLD-CLEAs酶活力回收率的影响
Fig.3 Effects of precipitants type and concentration on PLD-CLEAs activity recovery
戊二醛是CLEAs制备过程中最常用的双功能交联试剂。利用戊二醛作为交联剂,并探索不同浓度的戊二醛对PLD-CLEAs活性回收率的影响,结果如图4。
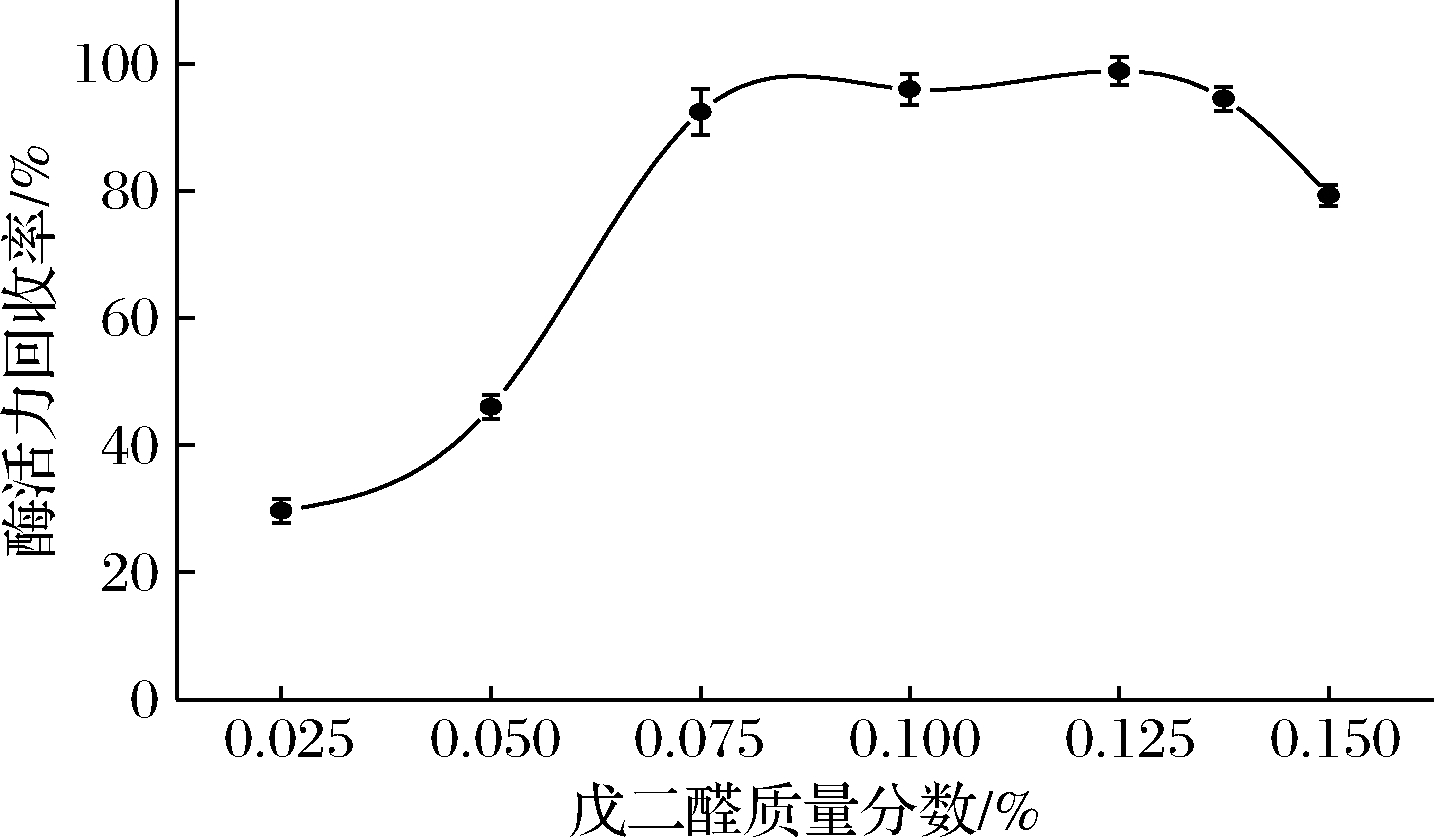
图4 戊二醛浓度对PLD-CLEAs酶活力回收率的影响
Fig.4 Effects of glutaraldehyde concentration on PLD-CLEAs activity recovery
由图4可知,戊二醛浓度较低时,酶活力回收率较低,主要是因为低浓度的戊二醛和酶之间的交联不充分,所得交联聚集体的酶损失较多;当戊二醛质量分数增加到0.125%时,PLD-CLEAs的酶活力回收率最高,但进一步提高戊二醛浓度后,酶活力回收率开始下降,可能是因为较小体积的戊二醛进入到酶分子内部并使其发生分子内交联,造成酶活性的损失[21];且高交联剂浓度下得到的大粒径CLEAs会影响酶与底物的结合,从而降低了酶催化速率[22]。因此,选取质量分数为0.125%的戊二醛为交联剂。
交联时间是制备CLEAs的重要影响因素之一。图5为不同交联时间对PLD-CLEAs酶活力回收率的影响。在实验时间范围(0.5~3 h)内,PLD-CLEAs的酶活力回收率随交联时间的延长先升高后降低,在1.5 h时达到最高值。在交联前期,随着时间的延长酶聚集体增多,得到的固定化酶的酶活力提高;交联时间超过1.5 h后,过多的酶聚集在一起,导致PLD-CLEAs空间位阻变大,且由于大量酶活性位点被包埋在聚集体内部而阻碍了酶与底物的接触,造成酶活力回收率下降。因此,制备PLD-CLEAs的最佳交联时间是1.5 h。
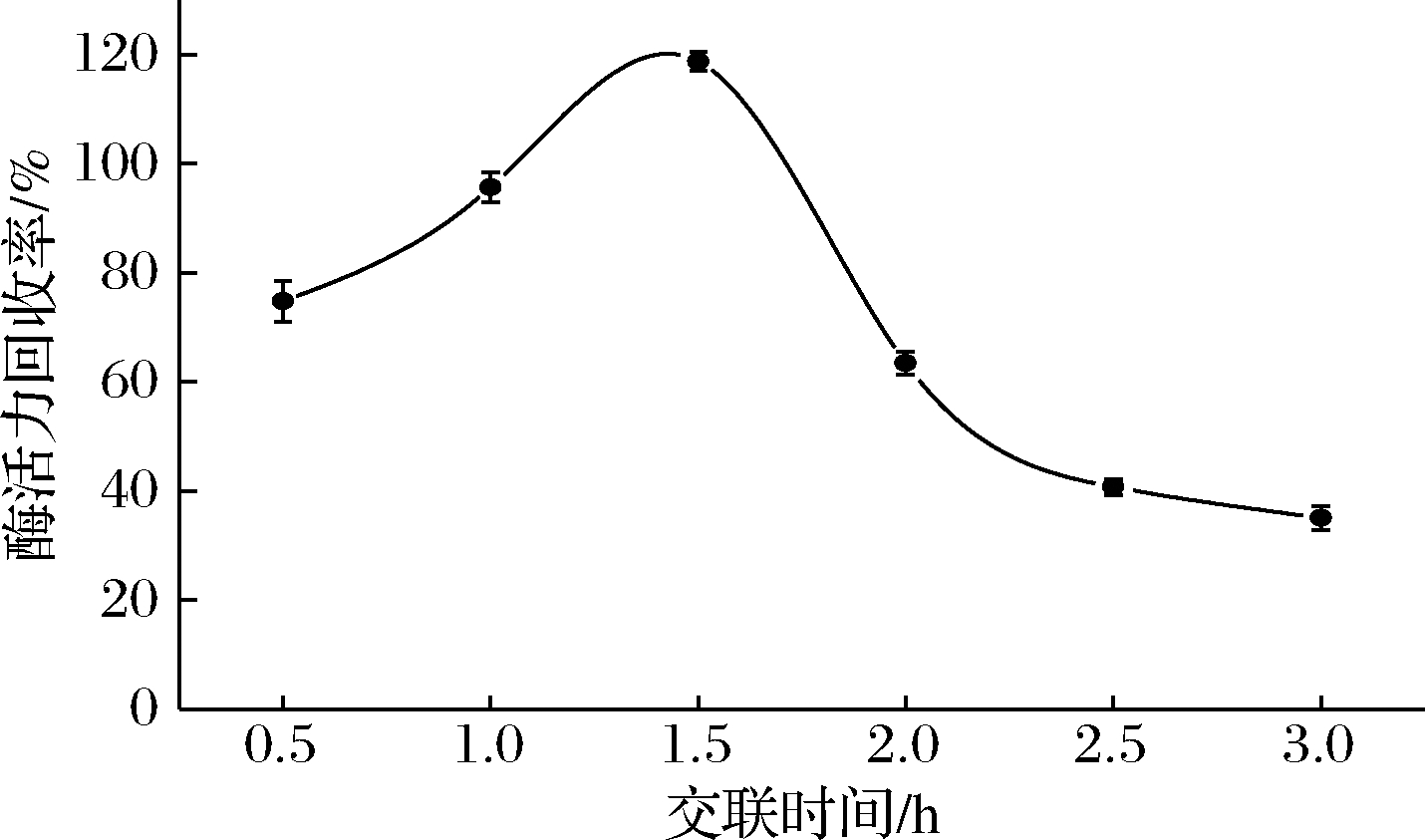
图5 交联时间对PLD-CLEAs酶活力回收率的影响
Fig.5 Effects of cross-linking time on PLD-CLEAs activity recovery
通过对PLD-CLEAs制备过程中的影响因素分析表明,以60%的硫酸铵溶液作为沉淀剂沉淀30 min后,加入0.125%的戊二醛交联1.5 h,PLD-CLEAs的酶活力回收率最高,为118.8%。这可能是由于酶分子经60%硫酸铵诱导所形成的超活化结构,通过戊二醛交联,成功地将高活性的酶构象保留了下来。
2.3 PLD-CLEAs的特性分析
2.3.1 最适催化温度
反应温度对PLD和PLD-CLEAs活性的影响见图6。在25~45 ℃,游离与固定化酶的活性均随温度的升高而增大,在45 ℃时两者的酶活性均达到最高值,且在相同反应温度下PLD-CLEAs的酶活力较高。当温度>45 ℃时,游离PLD的活性迅速下降,在65 ℃时的活性回收率仅为47.8%,而PLD-CLEAs在65 ℃时仍具有70.2%的酶活力。相较于游离酶,固定化酶提高了在较高温度下的反应活性,可能是由于戊二醛与酶分子之间的共价结合,提高了酶的刚性和构象稳定性,防止酶的构象转变并保护酶结构不被破坏,从而增强了酶抵抗外界条件的能力[23]。
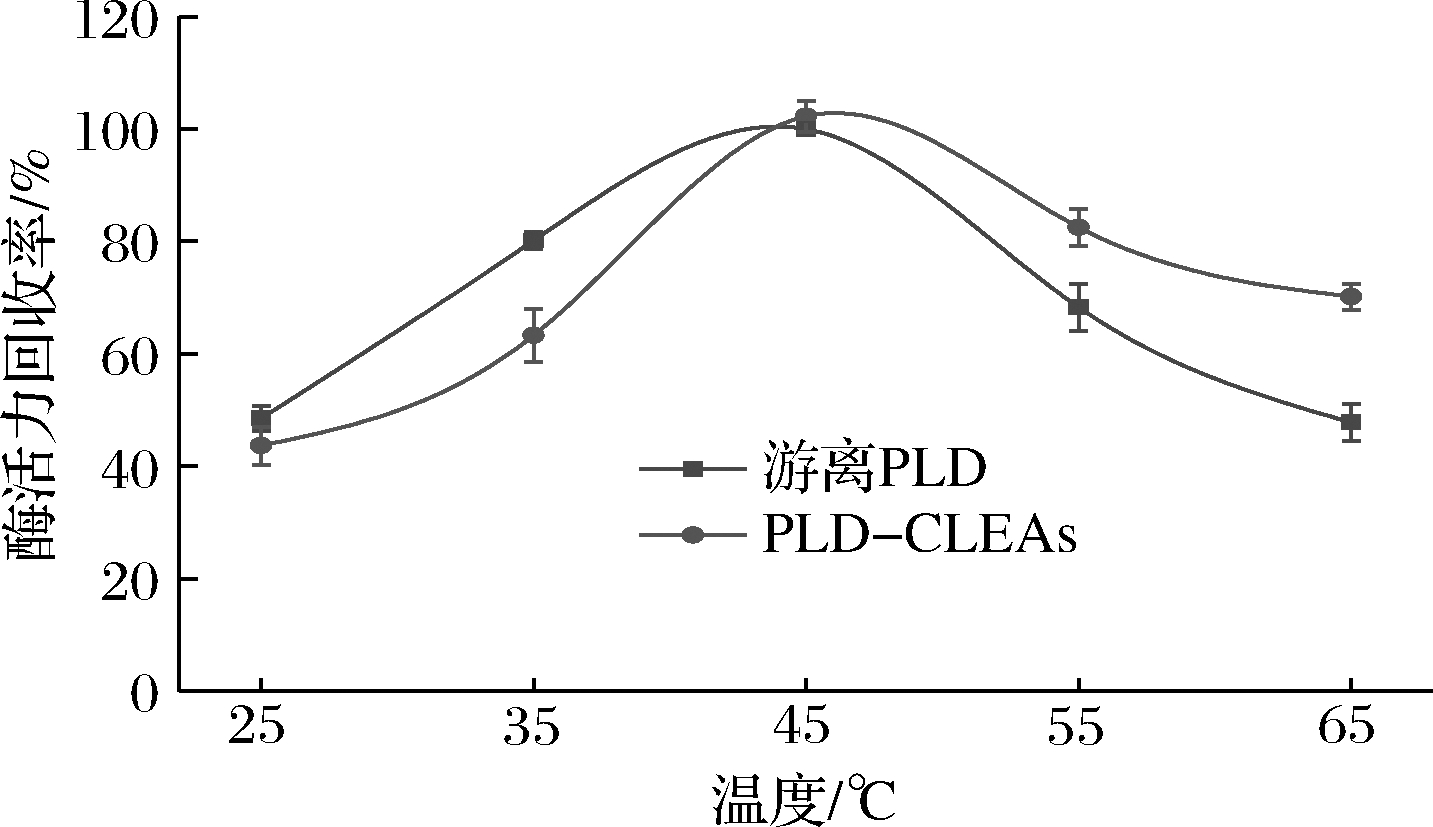
图6 反应温度对游离PLD和PLD-CLEAs活性的影响
Fig.6 Effect of temperature on the activities of free PLD and PLD-CLEAs
2.3.2 最适催化pH
酶的固定化通常会导致酶构象的变化,最适催化pH也会随之发生变化。反应pH对游离PLD和PLD-CLEAs活性的影响见图7,游离PLD的最适反应pH值为8.0,交联后的PLD-CLEAs的最适pH是7.0。在pH 5.0~9.0 PLD-CLEAs的酶活力均高于游离酶,说明PLD的交联固定化有利于稳定酶的结构[24];而当pH≥9.0时,游离酶的表现更好。表明得到的PLD-CLEAs在低pH条件下比游离酶的耐受性更好,拓宽了PLD的pH应用范围。
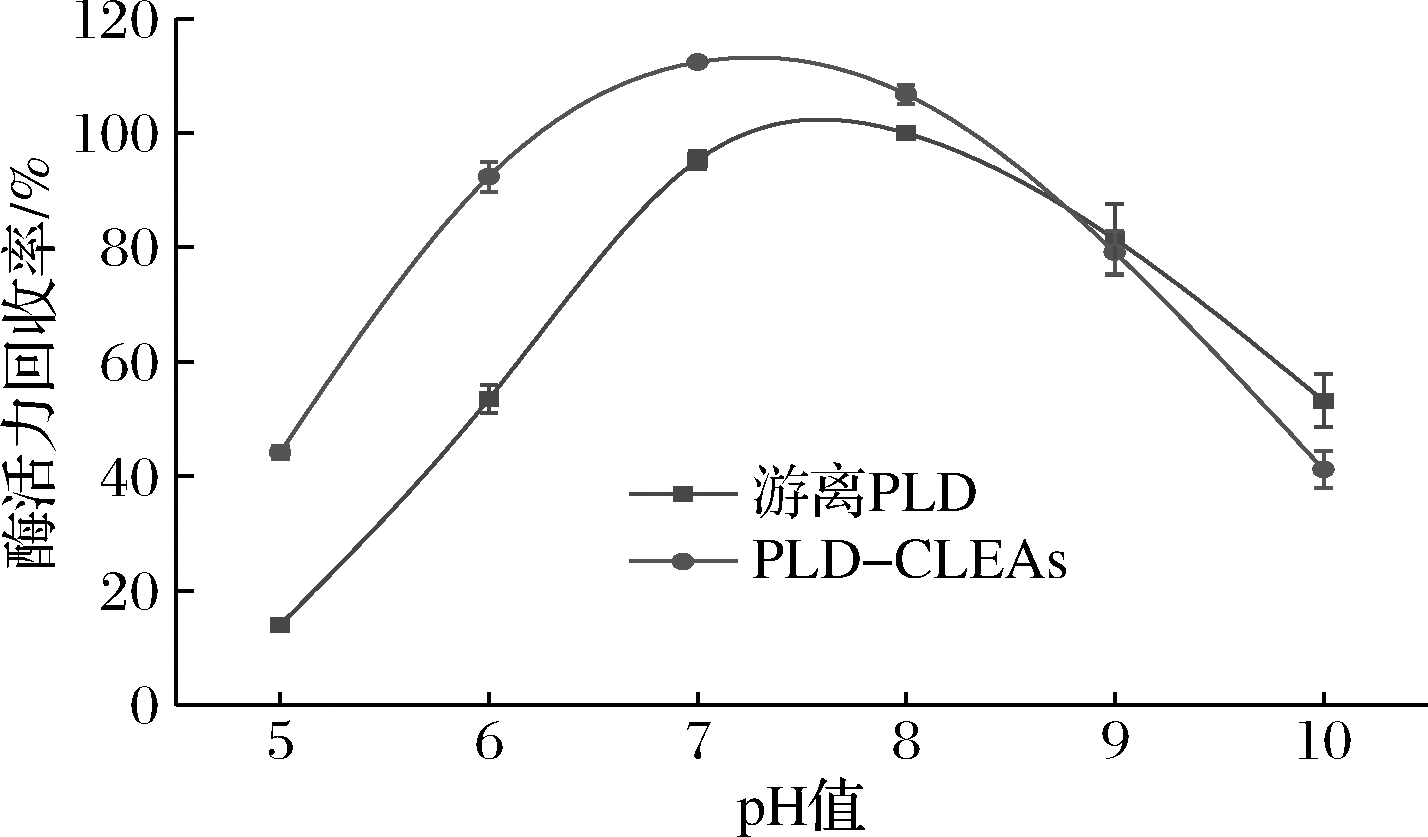
图7 反应pH对游离PLD和PLD-CLEAs活性的影响
Fig.7 Effect of pH on the activities of free PLD and PLD-CLEAs
2.3.3 热稳定性
为了更好地了解CLEAs对PLD热稳定性的影响,将游离PLD和PLD-CLEAs在50 ℃下保温不同时间(0~6 h)后,测定他们的剩余酶活力,结果如图8。随着保温时间的延长,游离PLD和PLD-CLEAs的活性逐渐降低,但PLD-CLEAs的下降速率明显小于游离酶的降低速率。保温2.5 h时,游离酶的活性仅为初始活性的51.3%,而PLD-CLEA仍保留78.6%的初始活性;当保温6 h后,PLD-CLEA的酶活力回收率高达52.2%,游离PLD已基本失活。表明PLD经戊二醛交联后,PLD-CLEA的抗热应力能力明显提高,这主要是因为酶分子间发生交联之后,酶分子间的多位点的共价结合增强了酶的刚性,防止酶的构象转变并保护酶结构不被破坏,使其发生构象变化和展开的可能性变小,因而提高了其在高温条件下的稳定性[25]。
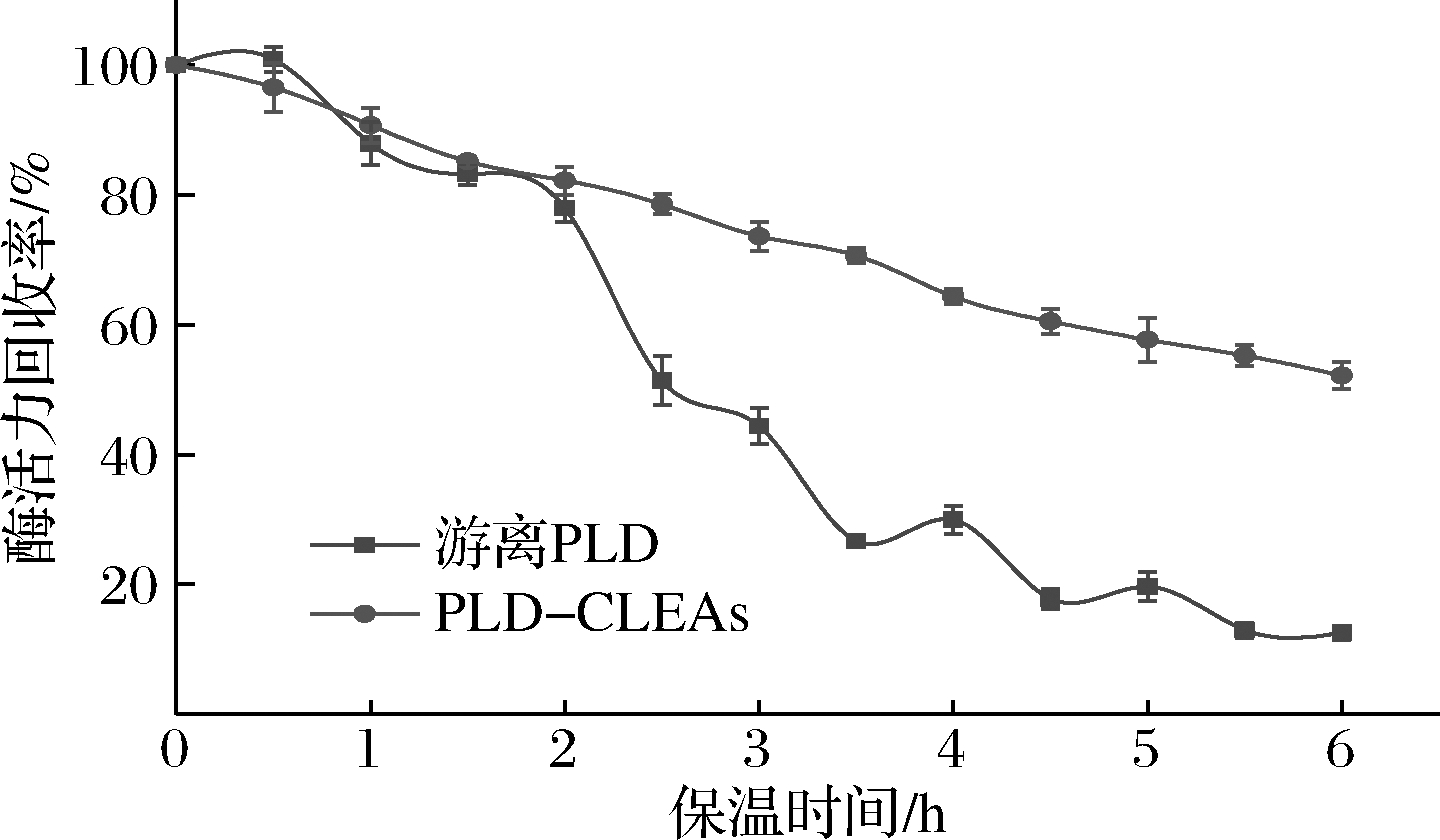
图8 游离PLD和PLD-CLEAs的热稳定性
Fig.8 Thermal stability of free PLD and PLD-CLEAs
2.3.4 固定化酶重复使用性
重复使用性是衡量固定化酶性能优劣的关键因素。以PC为底物,考察了PLD-CLEAs在连续使用10次后酶活力回收率的变化,结果见图9。

图9 固定化酶PLD-CLEAs的重复使用性
Fig.9 Reusability of PLD-CLEAs
由图9可知,随着使用次数的增加,PLD-CLEAs的酶活力回收率逐渐降低,在前7次的使用过程中,其酶活力降低较快,可能是由于CLEAs中的部分酶分子间没有充分交联,只是吸附在酶聚集体的表面,在反复洗涤和离心回收的过程中发生酶的脱落,导致酶活性降低[26];随着使用次数的增加,酶活力仍在下降,但下降速率减慢,这可能是由于酶在催化过程中的失活和离心过程中的机械损伤或损失造成的[20]。在重复使用10次后,剩余酶活性仍然保留了初始酶活力的50.4%,表现出良好的重复使用性。LI等[27]将生物印迹法活化后的PLD进行交联固定化后所得固定化酶重复使用10次后,活性仅保留初始活性的21.8%。因此,PLD-CLEAs不仅具有较高的催化活性和热稳定性,且具有良好的重复使用性。这些优异的特性使PLD-CLEAs成为一种非常有潜力的生物催化剂。
3 结论
本文采用CLEAs技术对PLD进行固定化,得到PLD-CLEAs。在硫酸铵饱和度为60%,戊二醛质量分数为0.125%,交联1.5 h时,PLD-CLEAs的最大酶活力回收率为118.8%。PLD-CLEAs对pH和温度的稳定性明显高于游离酶,且PLD-CLEAs具有良好的重复使用性。在重复使用10次后,PLD-CLEAs还能保持50%以上的酶活性。所制备的PLD-CLEAs在医药、化工等行业的具体应用需要进一步的研究,但其简单的制备、高效的回收、优异的催化性能和稳定的操作性都说明,PLD-CLEAs的性能优于游离酶,这使其在生物催化工业上有更大的应用潜力。
- 我用了一个很复杂的图,帮你们解释下“23版最新北大核心目录有效期问题”。
- 重磅!CSSCI来源期刊(2023-2024版)最新期刊目录看点分析!全网首发!
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?
- 《农业经济》论文投稿解析,难度指数四颗星,附好发选题!
- 期刊知识:学位论文完成后是否可以拆分成期刊论文发表?
- 号外!出书的人注意啦:近期专著书号有空缺!!

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



