QuEChERS-气相色谱-三重四级杆串联质谱法高通量检测生鲜肉中有机磷农药残留
有机磷农药(organophosphorus pesticides,OPPs)是一类含有磷原子的有机酯类化合物,因其高效、经济、广谱、易降解等特点而广泛用于农业生产中,主要用于防治植物病虫害[1]。OPPs经使用后残存于环境和植物体内,通过食物链富集进入动物体内,可对生鲜肉造成污染[2]。据报道,OPPs进入人体后,通过抑制胆碱酯酶活性,使机体发生功能性紊乱,导致机体出现一系列神经中毒症状,如出汗、震颤、精神错乱、语言失常等,严重者可导致呼吸麻痹而死亡[3]。因此,我国自2001年起已明令禁止使用对硫磷、久效磷、甲胺磷等高毒有机磷农药,并限制使用毒死蜱、三唑磷、敌敌畏等中毒有机磷农药[4]。世界各国和国际组织也制定了动物源食品中农药最大残留限量(maximum residue limits,MRLs)。例如,国际食品法典委员会(Codex Alimentarius Commission,CAC)规定39种动物源产品中1 021项农药MRLs[5];韩国规定35种动物源产品中7 941项农药MRLs[6];我国GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》规定27种动物源产品中903项农药MRLs。
生鲜肉因脂肪、蛋白含量较高,致使其基质较为复杂。因此,为减少农药检测过程中基质干扰现象,选择合适的样品前处理方法显得尤为重要。迄今,生鲜肉中农药残留检测的前处理方法主要有固相萃取法[7]、加速溶剂萃取法[8]、凝胶渗透色谱净化[9]、QuEChERS(quick,easy,cheap,effective,rugged,safe)[10]等。现有方法虽各有优势,但也存在着缺点和局限性,如凝胶渗透色谱和加速溶剂萃取法虽能准确分离出农药残留组分,但溶剂消耗量大、操作繁琐、易造成二次污染[11]。QuEChERS法作为近年来新兴的样品前处理技术,因其净化过程简单、快速、高效、经济等优点,已广泛应用于食品、环境、生物等领域[12]。因此,本实验选择QuEChERS法对生鲜肉进行前处理。农药残留的检测技术主要有酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)[13]、GC[14]、HPLC[15]、GC-MS、GC-MS/MS[16]、LC-MS/MS[17-18]等。其中,ELISA主要用于大批样品的初步筛查,抗体有效性短,易出现假阳性结果[13];GC与GC-MS检测范围有限,不利于挥发性小、分子质量大的样品检测[16];HPLC与LC-MS/MS常用于挥发性小,热稳定性差的样品检测,检测农药种类少[19]。较之上述方法,GC-MS/MS具有较高灵敏度和抗干扰能力,分析结果准确可靠,适用于痕量物质的检测[20]。因此,本实验基于QuEChERS前处理方法,建立了一种可同时检测生鲜肉中18种OPPs的GC-MS/MS方法。该方法的建立为我国生鲜肉中农药残留的高通量快速检测以及食品安全监管提供科学支持。
1 材料与方法
1.1 材料与试剂
生鲜猪肉、牛肉、羊肉、鸡肉、鸭肉,江苏省南京市超市和农贸市场;阴性畜禽肉,农业农村部肉及肉制品质量监督检验测试中心(南京)。
标准品:敌敌畏(dichlorvos)、虫螨磷(insecticidal phosphorus)、速灭磷(mevinphos)、二嗪磷(diazinon)、三唑磷(triazophos)、灭线磷(ethoprophos)、皮蝇磷(fenchlorphos)、杀螟硫磷(fenitrothion)、毒死蜱(chlorpyrifos)、倍硫磷(fenthion)、对硫磷(parathion)、乙硫磷(ethion)、地虫硫磷(fonofos)、甲拌磷(phorate)、久效磷(monocrotophos)、马拉硫磷(malathion)、乙拌磷(disulfoton)、特丁硫磷(terbufos),质量浓度均为100 μg/mL,上海安谱实验科技股份有限公司。
试剂:乙腈、正己烷、乙酸乙酯,丙酮,均为色谱纯,MgSO4、NaCl、CH3COONa,均为分析纯,上海安谱实验科技股份有限公司;N-丙基乙二胺(primary secondary amine,PSA)、十八烷基键合硅胶(C18),粒径均为40 μm,美国安捷伦科技有限公司;实验所用水均为一级水。
1.2 仪器与设备
TSQ 8000 EVO三重四级杆气质联用仪,赛默飞世尔科技(中国)有限公司;DB-1701色谱柱(30 m×0.25 mm,0.25 μm),美国安捷伦科技有限公司;D-16C高速冷冻离心机、arium® advance EDI纯水仪,德国Sartorius公司;N-EVAP型氮吹仪,美国Organomation公司;Vortex Genius漩涡混匀器,德国IKA公司。
1.3 实验方法
1.3.1 样品前处理
提取:准确称取5.00 g(精确至0.01 g)均质样品于50 mL离心管中,加入10 mL饱和正己烷的乙腈溶液提取,涡旋混匀1 min;加入1 g MgSO4和1.5 g CH3COONa,涡旋混匀1 min,4 ℃下10 000 r/min离心5 min。
净化:转移上清液,置于装有净化材料(1 g MgSO4、0.15 g PSA、0.15 g C18)离心管中,涡旋振荡1 min,4 ℃下10 000 r/min离心5 min;转移上清液于新的50 mL离心管中,35 ℃氮吹至近干,加入1 mL乙酸乙酯复溶;复溶液过0.22 μm滤膜,供GC-MS/MS分析检测。
1.3.2 标准溶液的配制
标准中间溶液:将18种质量浓度为100.0 mg/L的OPPs标准品,根据其理化性质和测定条件以丙酮为溶剂稀释定容至各农药质量浓度为5.00 mg/L,-20 ℃保存备用。
标准工作溶液:精确移取一定量标准中间溶液,用丙酮稀释定容至质量浓度为1.00 mg/L的标准工作溶液,-20 ℃保存备用。
标准工作曲线:精确移取一定量标准工作溶液,用丙酮稀释至各质量浓度为0.005、0.01、0.02、0.05、0.10、0.20、0.50 mg/L的标准工作曲线溶液,现配现用。
1.3.3 GC-MS/MS方法的建立
气相色谱条件:色谱柱:Agilent DB-1701(30 m×0.25 mm,0.25 μm);载气:高纯氦气(99.999%);流速1.0 mL/min;进样方式:不分流进样;进样量1 μL;进样口温度280 ℃;升温程序:初始温度50 ℃保持2 min,以30 ℃/min升温至180 ℃,再以10 ℃/min升温至260 ℃。
质谱条件:电离方式:电子轰击源(electron impact ion source,EI);电离能量70 eV;离子源温度230 ℃;传输线温度270 ℃;扫描离子范围50~500 u;扫描方式:多反应离子监测(multi-reactive ion monitoring,MRM)。
1.3.4 基质效应
基质效应(matrix effects,ME)是指样品中除分析物以外的其他成分对待测物产生干扰,从而引起待测组分信号抑制或增强[21]。实际工作中ME通常以基质标准曲线与纯溶剂标准曲线两者斜率(k)之比来进行评估,即ME=k基质标准曲线/k纯溶剂标准曲线。当ME>1时,为基质增强效应;ME<1为基质减弱效应;ME=1,则不存在基质干扰现象。一般认为,当ME比值为0.8~1.2时,为弱基质效应;当ME>1.2或<0.8时,ME较强[22]。
1.3.5 线性范围的确定
基于已建立的GC-MS/MS方法,分别以阴性猪肉、牛肉、羊肉、鸡肉、鸭肉为基质,配制7个不同梯度(0.005~0.50 mg/L)的混合基质标准溶液。经检测,最低点浓度出峰状况良好,最高点浓度也在仪器检测范围之内,能够满足本实验对不同组分相关系数的要求。以定量离子质量色谱图峰面积为纵坐标(Y),对应溶液质量浓度(mg/L)为横坐标(X),绘制标准曲线,计算平方相关系数(square of correlation coefficient,R2)。
1.3.6 检出限和定量限
分别以阴性猪肉、牛肉、羊肉、鸡肉、鸭肉的低浓度添加水平(5.00 μg/kg)进行测定,平行测定10份样品。以信噪比S/N=3和S/N=10所对应浓度,分别计算出各组分在5种基质中的检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ)[23]。
1.3.7 准确度和精密度试验
分别以阴性猪肉、牛肉、羊肉、鸡肉、鸭肉为基质进行低、中、高3个水平(5.00、10.00、20.00 μg/kg)的加标回收试验,每个水平平行测定6次,计算平均加标回收率和相对标准偏差(relative standard deviation,RSD)。
1.3.8 方法的实际应用
选用市售生鲜肉30份,其中猪、牛、羊、鸡、鸭各6份,15份购自超市,15份购自农贸市场,参照1.3.1和1.3.3节进行样品前处理和上机测定,以此评价该方法的实际应用效果。
2 结果与分析
2.1 前处理条件优化
2.1.1 提取溶剂的优化
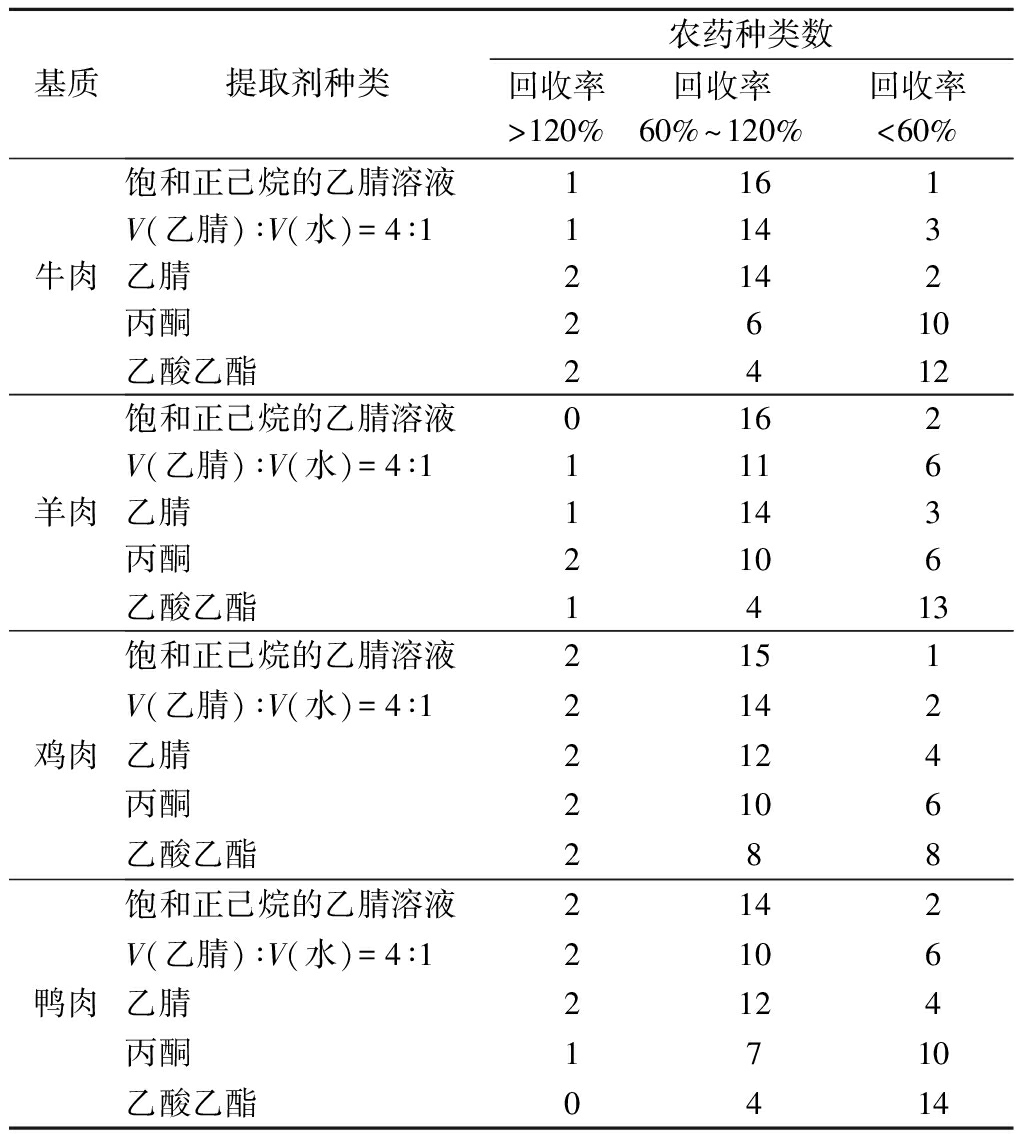
鉴于18种OPPs的分子极性差异,本试验分别采用乙腈、饱和正己烷的乙腈溶液、V(乙腈)∶V(水)=4∶1、丙酮、乙酸乙酯作为样品提取溶剂。在其他试验条件相同情况下,分别向5种阴性基质中添加20 μg/kg OPPs混合标准溶液,以18种农药回收率为指标,比较5种不同提取剂的提取效果。由表1可知,饱和正己烷的乙腈溶液在5种基质中均呈现出最佳的提取效果,其回收率最高。因此,本试验选择饱和正己烷的乙腈溶液作为样品提取剂。
表1 提取溶剂对18种农药回收率的影响
Table 1 Effect of extraction solvents on the recovery of 18 pesticides
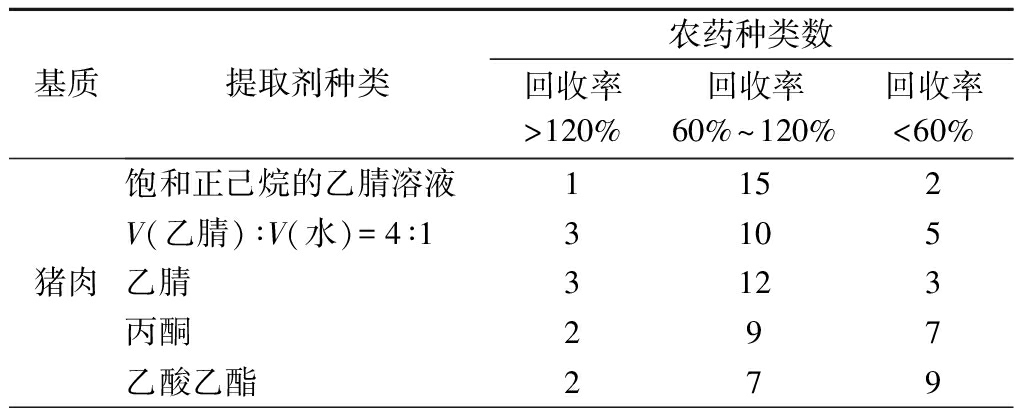
续表1
2.1.2 缓冲体系的优化
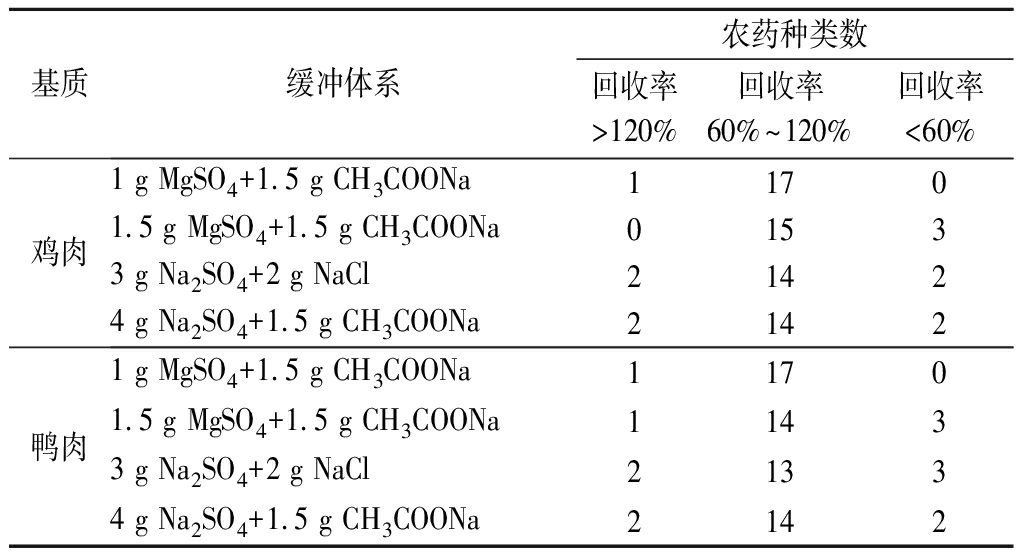
样品经提取后,向提取液中加入缓冲体系能使其整体状态更加均一,同时利用盐析作用,经离心后可使水相、有机相更易分层。本试验分别考察了4种缓冲体系组合对提取效果的影响,在其他试验条件相同情况下,分别向5种阴性基质中添加20 μg/kg OPPs混合标准溶液,以18种农药回收率为指标,比较不同缓冲体系的萃取效果。由表2可知:缓冲体系(1 g MgSO4+1.5 g CH3COONa)在5种基质中的萃取效果最佳,回收率最高。因此,本试验选择1 g MgSO4和1.5 g CH3COONa作为缓冲体系。
表2 缓冲体系对18种农药回收率的影响
Table 2 Effect of buffer system on the recovery of 18 pesticides
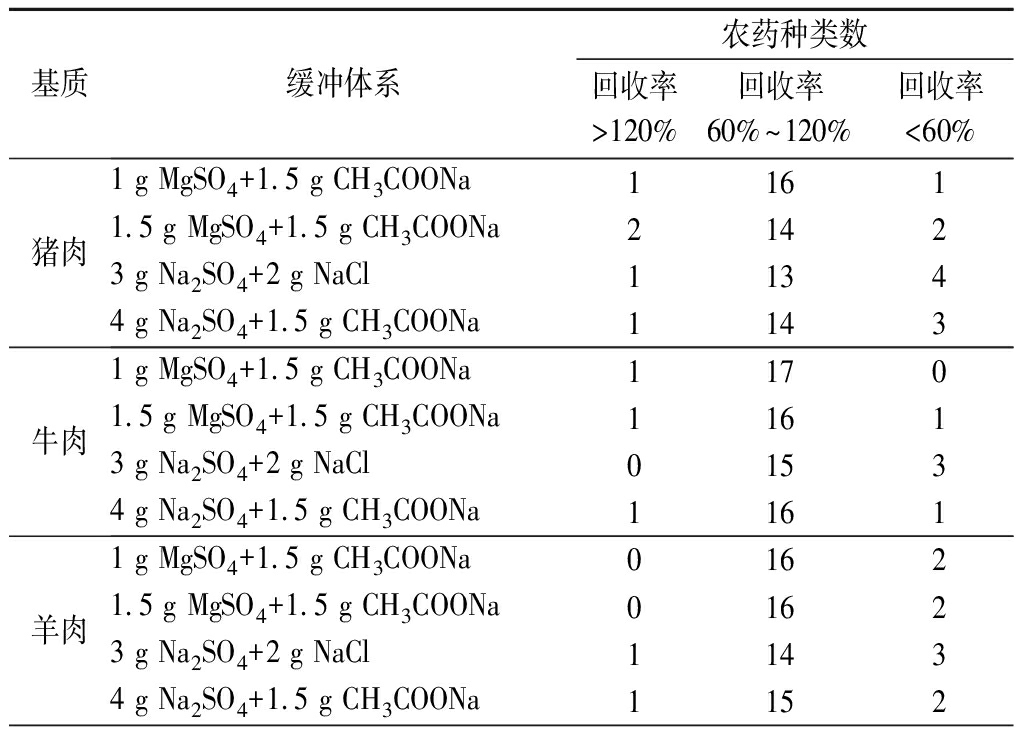
续表2
2.1.3 吸附剂用量的优化
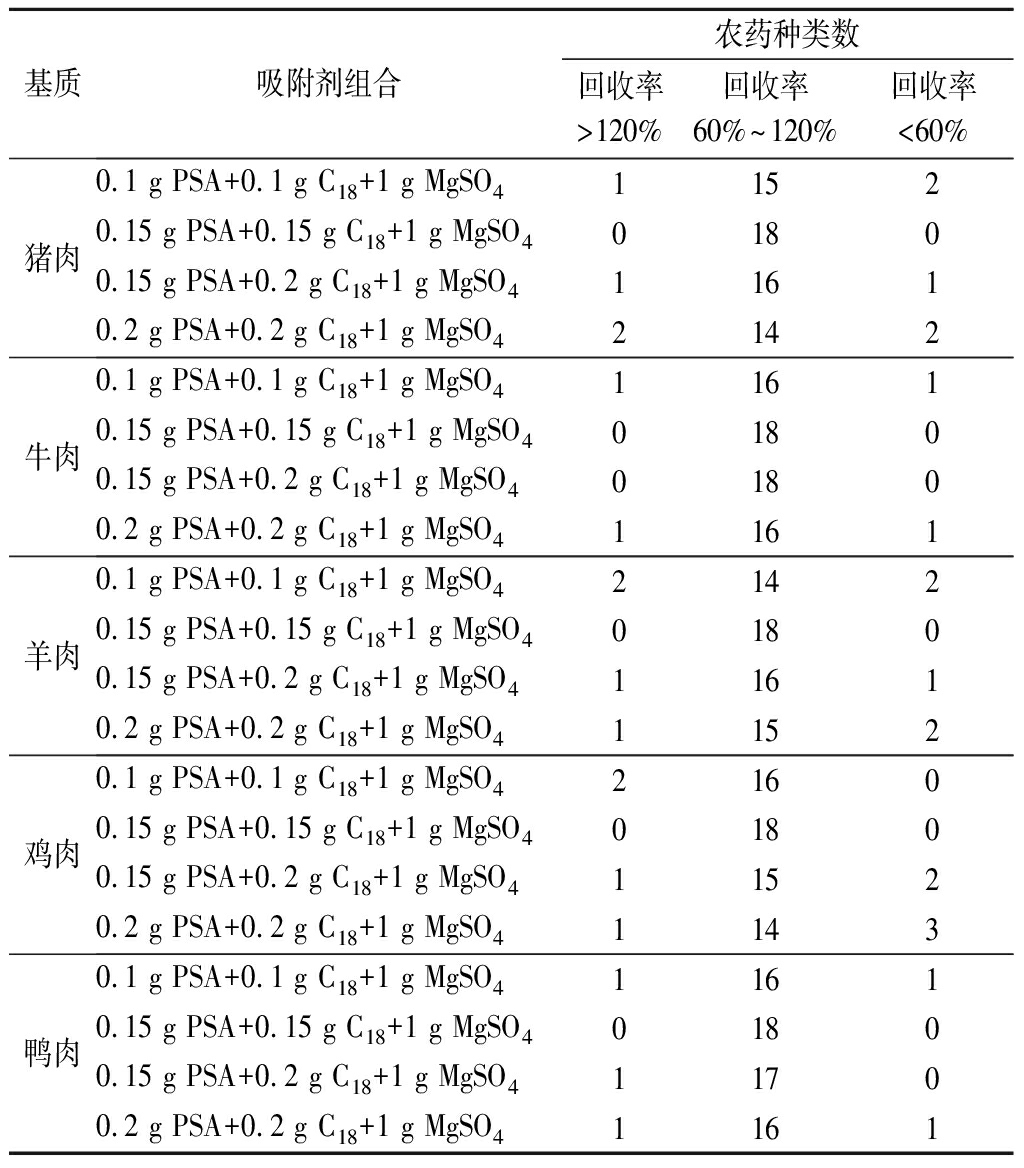
生鲜肉种类繁多,其基质也较为复杂,因此需根据样品基质类型,选择合适配比的净化材料。本试验分别考察了4种吸附剂组合对净化效果的影响,在其他试验条件相同情况下,分别向5种阴性基质中添加20 μg/kg OPPs混合标准溶液,以18种农药回收率为指标,比较不同吸附剂的净化效果。由表3可知,吸附剂(0.15 g PSA+0.15 g C18+1 g MgSO4)在5种基质中的净化效果最佳,回收率均为60%~120%。因此,本试验选择吸附剂(0.15 g PSA+0.15 gC18+1 g MgSO4)组合对样品进行净化。
表3 吸附剂组合对18种农药回收率的影响
Table 3 Effect of adsorbent combinations on the recovery of 18 pesticides
2.2 GC-MS/MS条件优化
通过优化GC条件,18种OPPs用DB-1701色谱柱均能实现较好地分离,且响应高,无杂峰。因此,本试验在1.3.3节选定的色谱条件下,对每种农药进行全扫描分析,得到18种OPPs标准工作溶液总离子流图(图1)。从总离子流图中确定每种农药的保留时间,并选择质荷比较大、丰度高的特征离子作为母离子。对选定的母离子用选择离子方式进行扫描,从二级质谱图中选择1~2个离子作为子离子,在MRM模式下,进行碰撞能量优化,优化结果见增强出版附表1。
附表1 18种OPPs保留时间、定量离子、定性离子
Appendix 1 Retention time,quantitative ion and qualitative ion of 18 OPPs
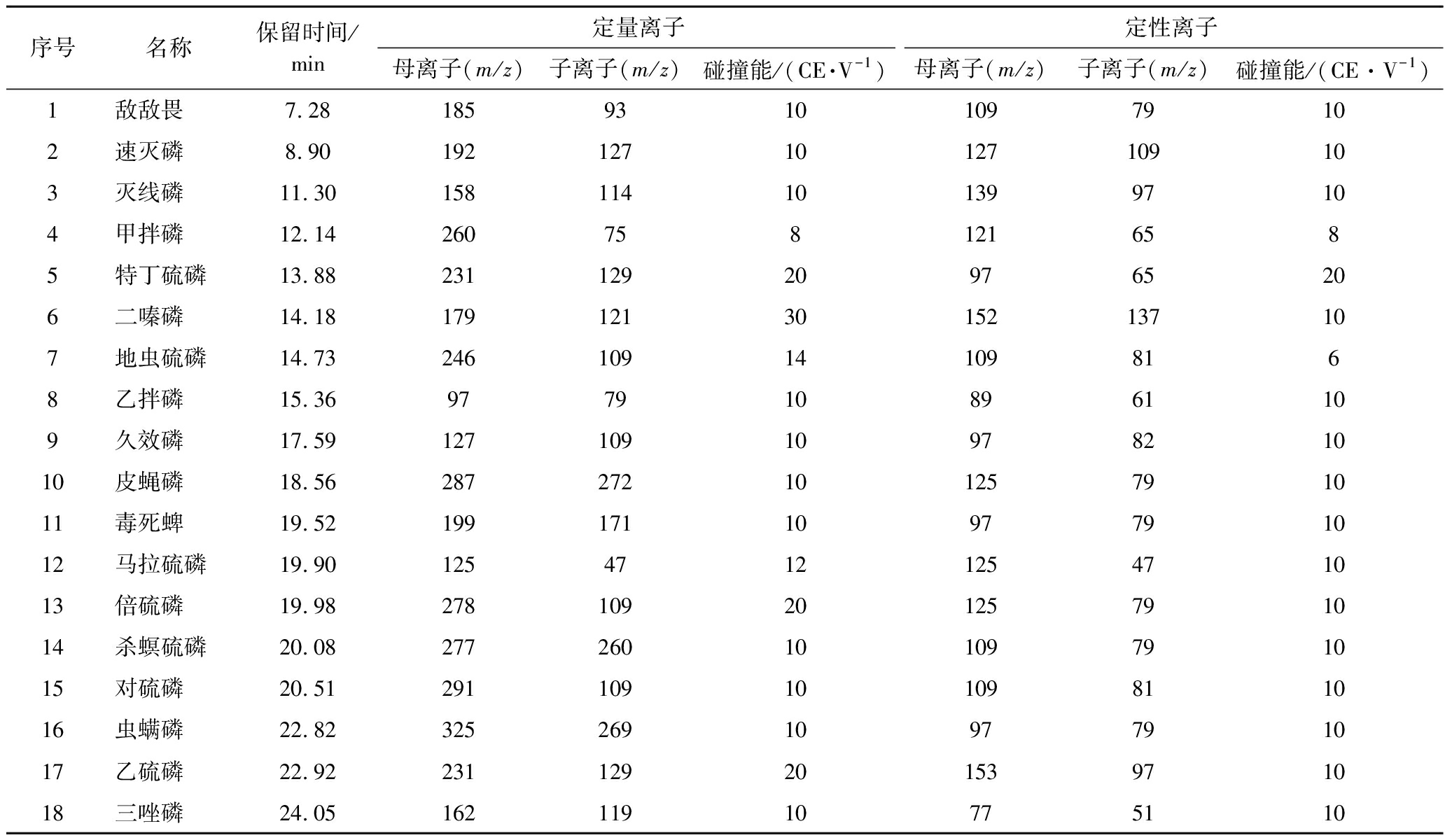
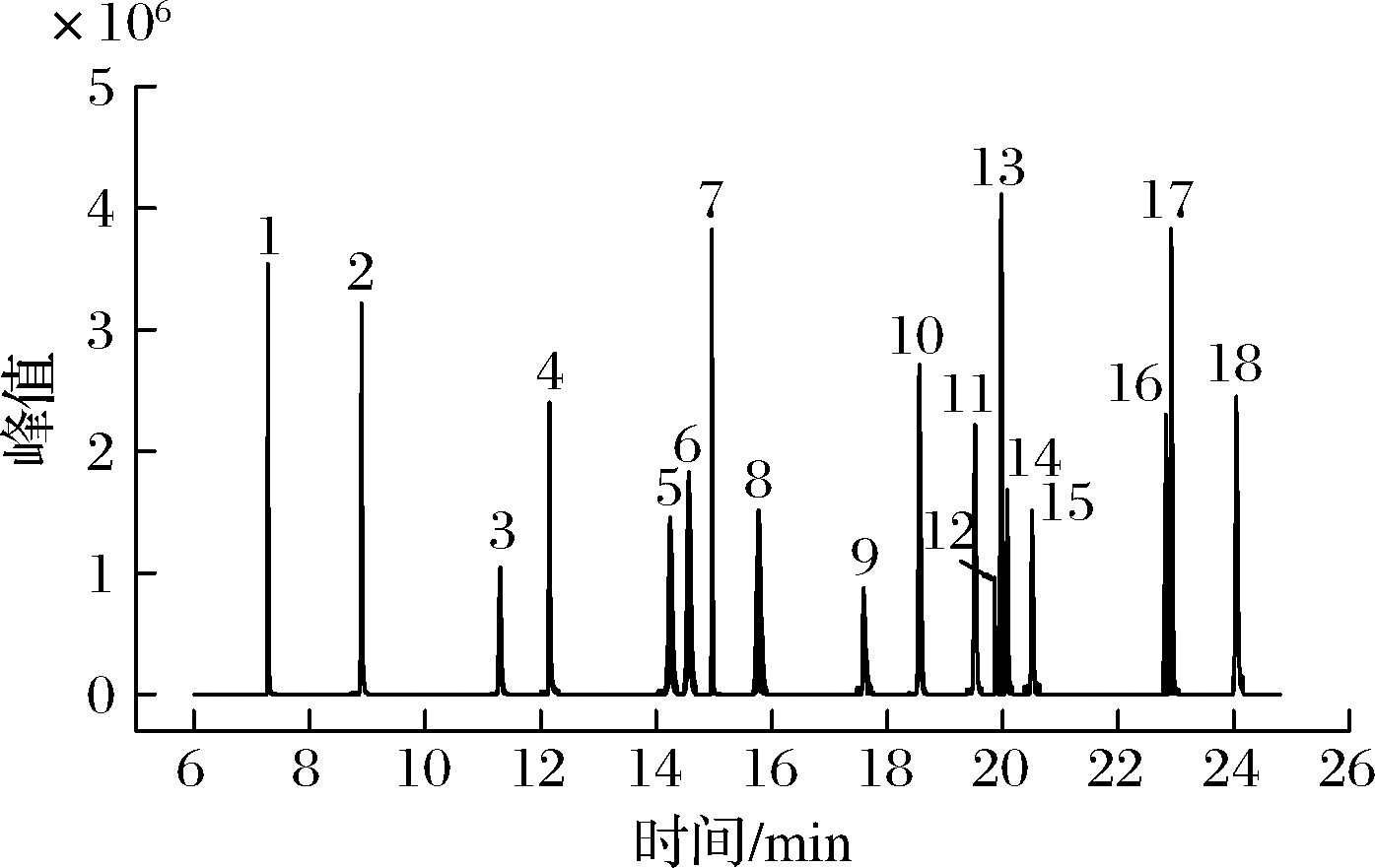
图1 18种OPPs标准工作溶液总离子流图
Fig.1 Total ion chromatogram of 18 OPPs standard working solution
注:1-敌敌畏;2-速灭磷;3-灭线磷;4-甲拌磷;5-特丁硫磷;6-二嗪磷;7-地虫硫磷;8-乙拌磷;9-久效磷;10-皮蝇磷;11-毒死蜱;12-马拉硫磷;13-倍硫磷;14-杀螟硫磷;15-对硫磷;16-虫螨磷;17-乙硫磷;18-三唑磷
2.3 基质效应
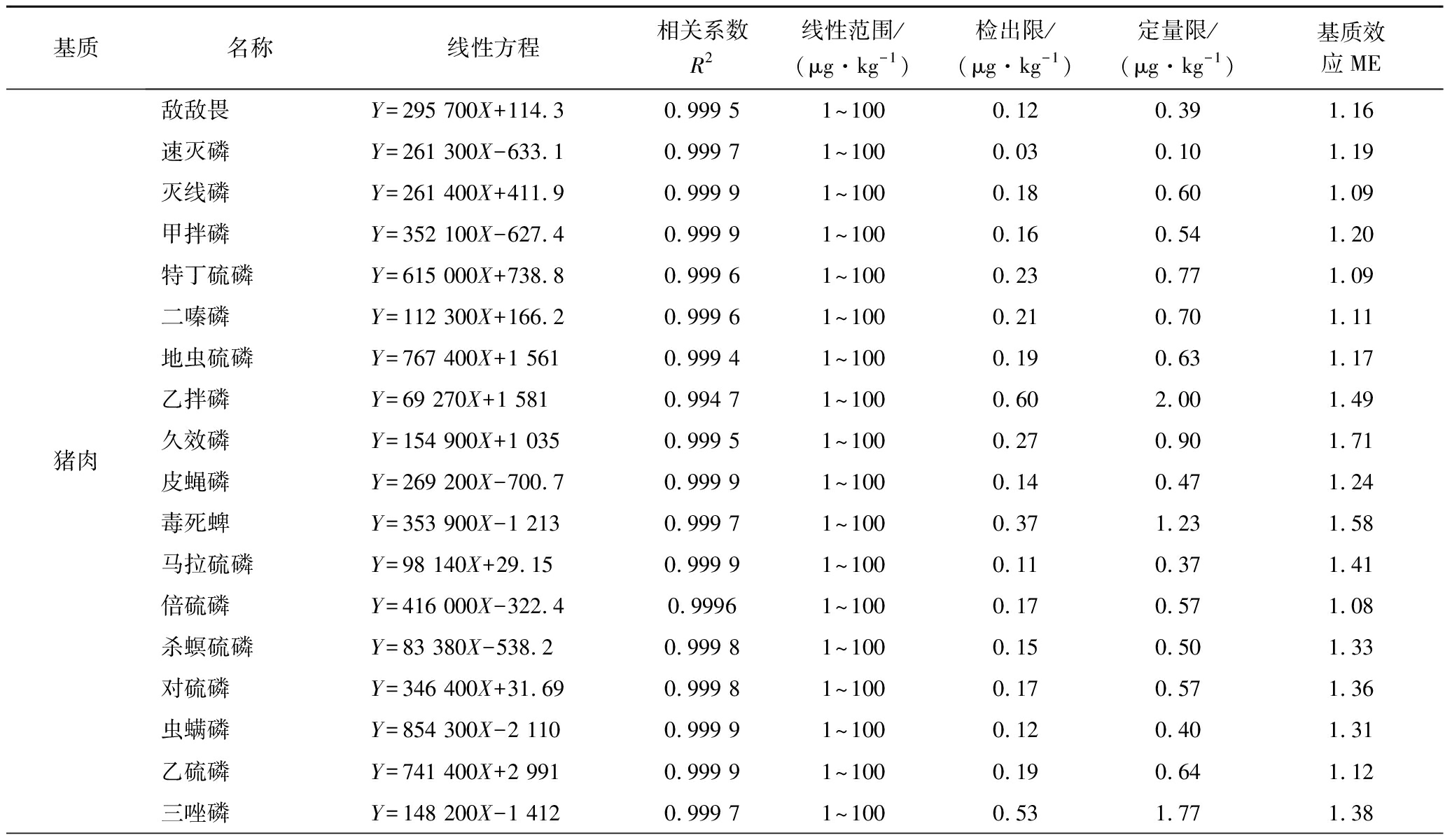
由增强出版附表2可知,18种农药在5种基质中均呈现出基质增强效应。本实验虽通过优化前处理方法减少了其基质干扰,但仍有部分农药ME较强(ME>1.2)。因此,为克服基质效应和确保分析方法的准确性,本试验最终采用基质匹配标准溶液进行校正。
附表2 18种OPPs的线性方程、相关系数及检出限、定量限、基质效应
Appendix 2 Linear equations,correlation coefficients and detection limits,quantification limits,and matrix effects of 18 OPPs
附表续表2
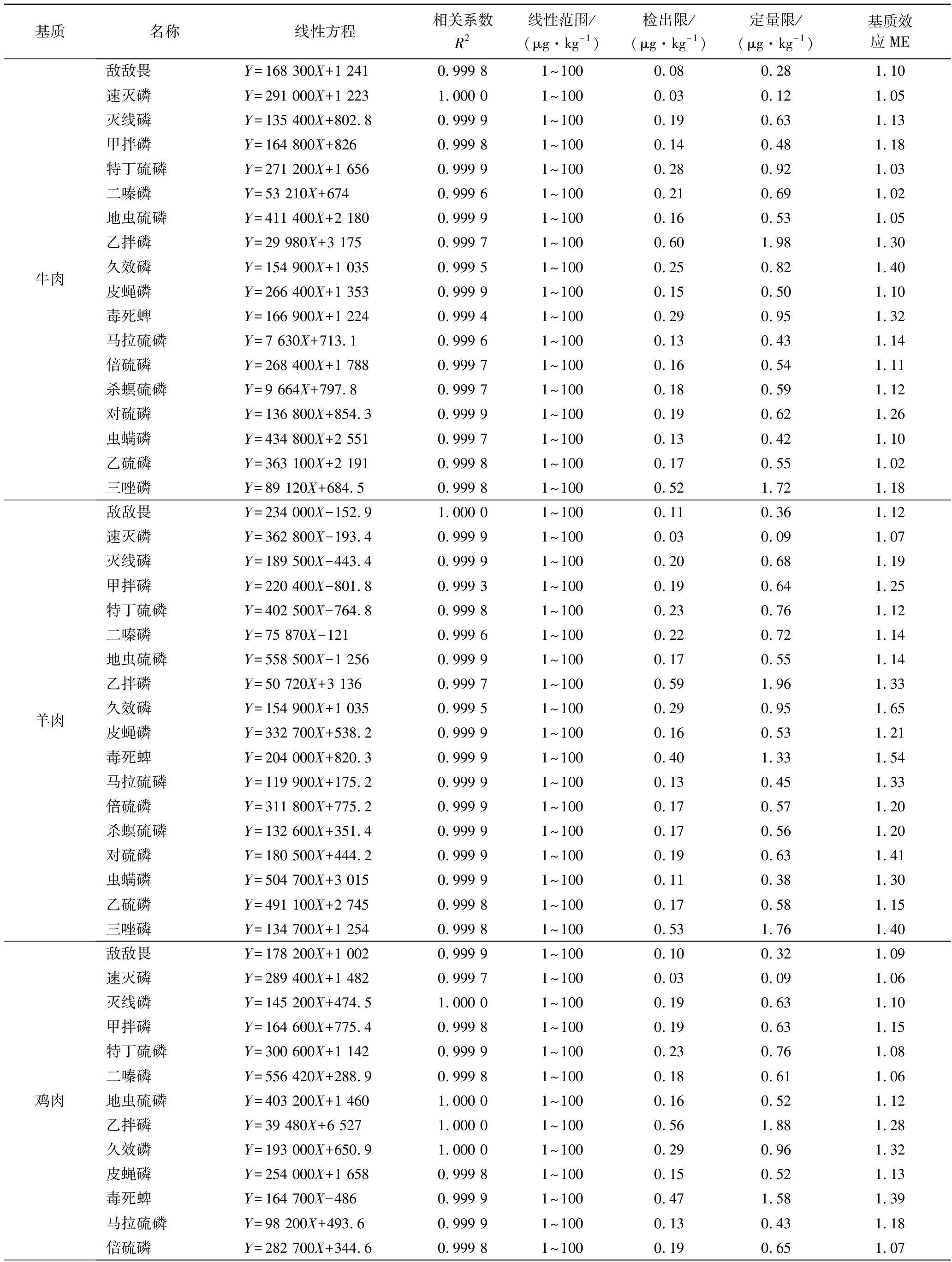
附表续表2

2.4 方法学验证
2.4.1 方法的线性范围、检出限和定量限
本试验采用空白基质提取液配制基质匹配标准工作溶液,共设置7个浓度点,绘制标准曲线。由增强出版附表3可见,每种农药在1~100 μg/kg均呈现良好线性关系(R2>0.990 0),检出限为0.02~0.74 μg/kg,定量限为0.08~2.48 μg/kg。
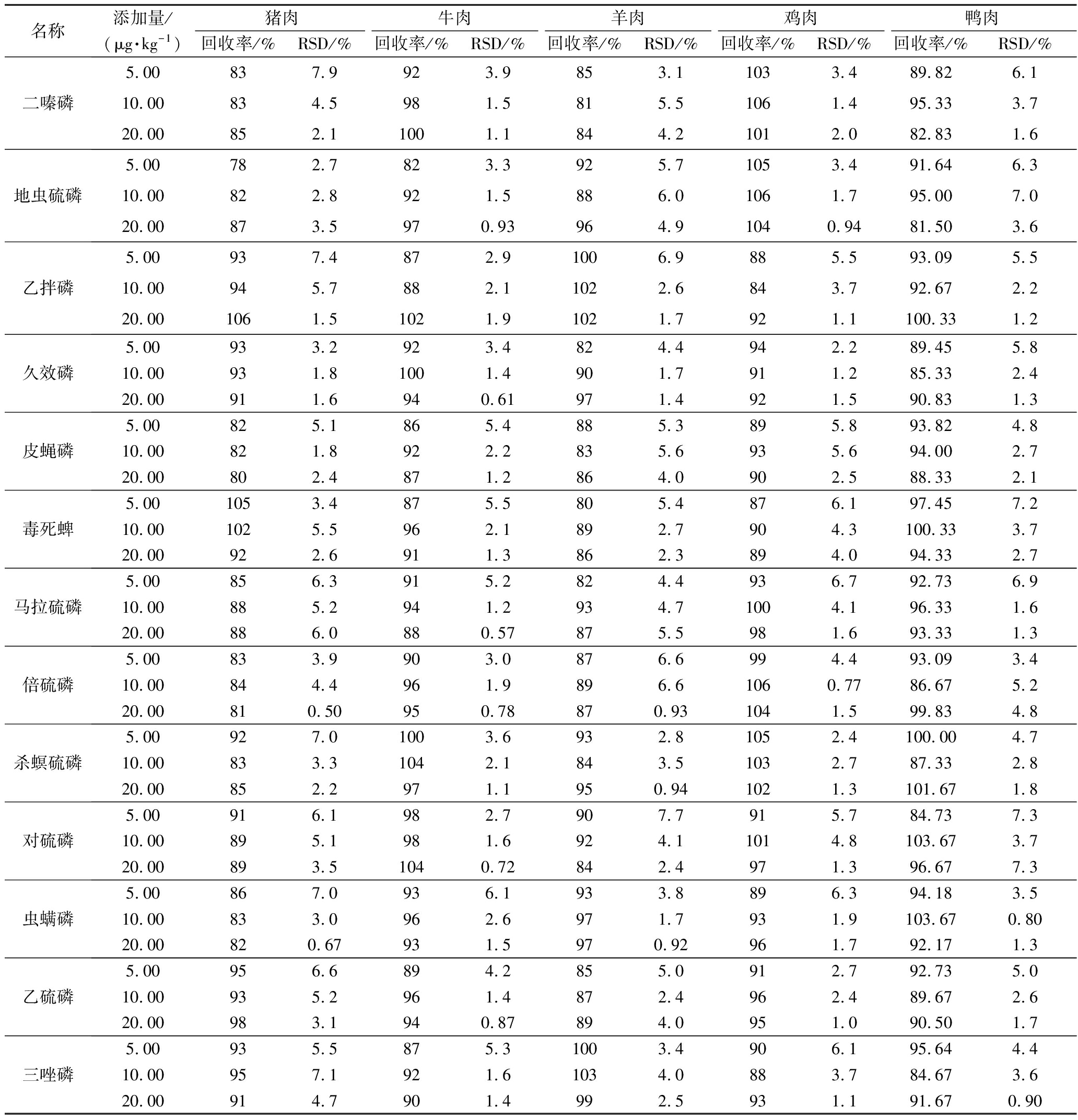
附表3 18种OPPs的加标回收率和RSD(n=6)
Appendix 3 The recovery rate and relative standard deviation of 18 OPPs(n=6)
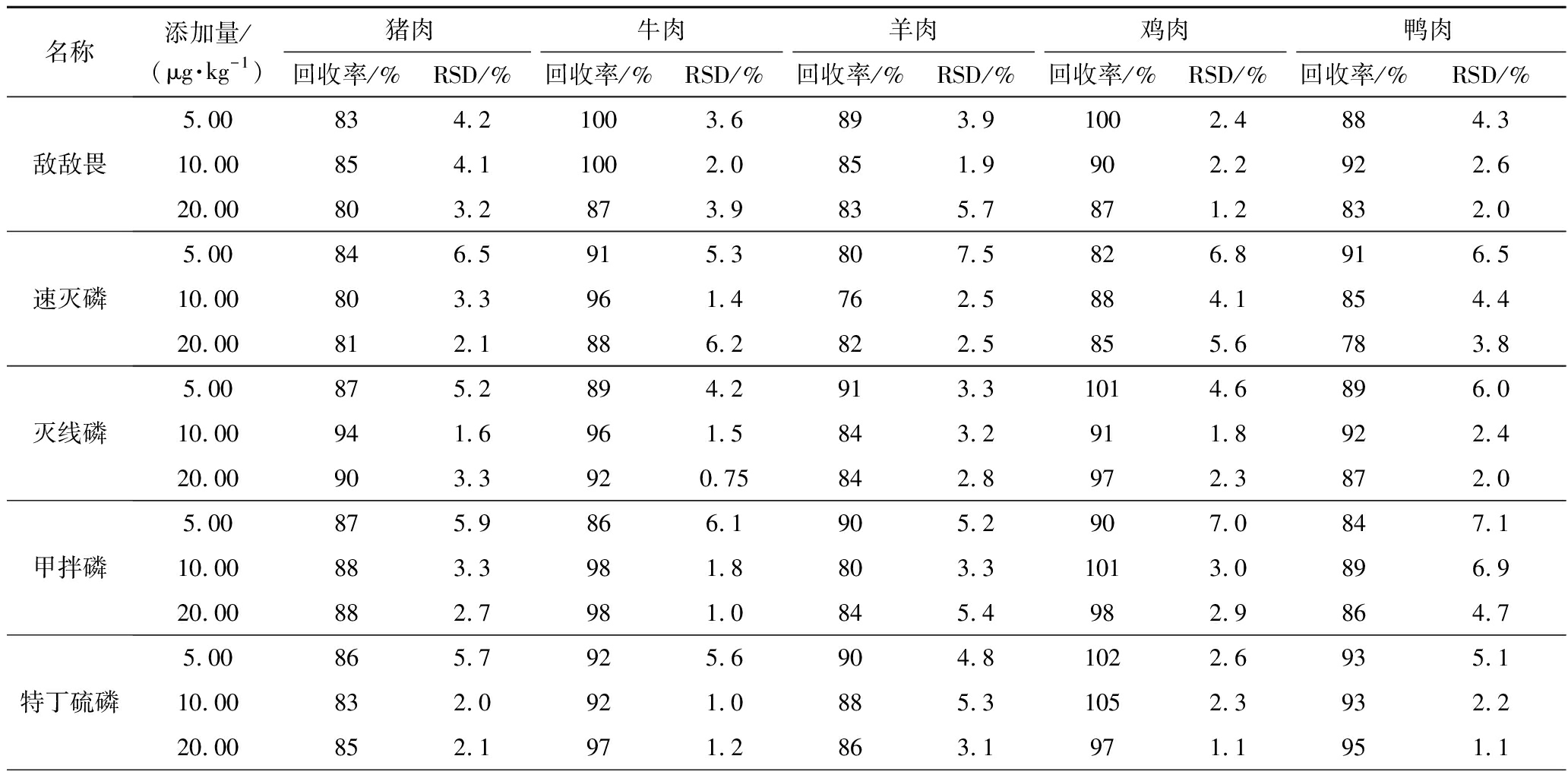
附表续表3
2.4.2 方法添加回收率和精密度
根据GB 2763—2021规定,生鲜肉中农药残留限量一般在10 μg/kg。因此,本试验选取1/2限量、限量及2倍限量对每种基质进行低、中、高3个水平(5、10、20 μg/kg)的加标回收试验。由表6可知,样品平均回收率为76%~106%,RSD为0.50%~7.9%。
2.5 方法实际应用评价
为证实本方法的实际应用价值,分别在超市和农贸市场随机选取30份生鲜肉作为研究对象,采用本试验建立的方法进行检测。由表4可知,在1份牛肉中检出马拉硫磷(0.8 μg/kg),1份羊肉中检出倍硫磷(0.6 μg/kg)。
表4 市售产品中农药检测结果 单位:μg/kg
Table 4 Detection results of pesticides in commercial products
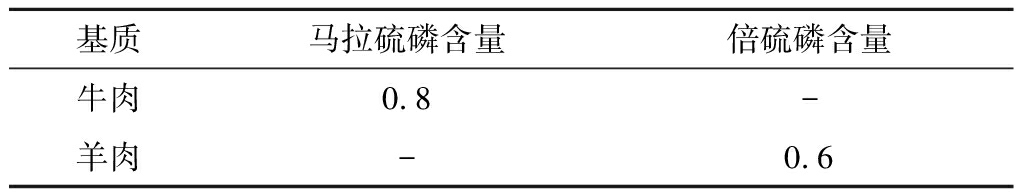
注:“-”未检出
3 讨论
GC-MS/MS法具有灵敏度好、准确度高,定性性能强等优点,能够实现多种农药残留的高通量快速检测。本文采用GC-MS/MS法检测生鲜肉中18种OPPs残留,所有检测目标物分离良好,重现性好,并基于优化的QuEChERS法进行样品前处理,可有效降低畜禽肉中脂肪、蛋白质及色素等基质干扰,提高目标物回收率,其中猪肉、羊肉因脂肪含量高,基质效应强,其回收率略低于其他肉类。
本研究建立了一种QuEChERS结合GC-MS/MS检测生鲜肉中18种OPPs残留的分析方法。18种OPPs的检出限可达0.02~0.74 μg/kg,定量限0.08~2.48 μg/kg,均低于文献[24-26]的报道。低、中、高3个浓度水平的加标回收率在76%~106%,RSD为0.50%~7.9%,方法的回收率和精密度符合GB/T 27404—2008《实验室质量控制规范 食品理化检测》对回收率和精密度的要求。该方法在实际应用中简单、快速、高效,可满足生鲜肉中18种OPPs残留的高通量快速检测,对加强生鲜肉在整个流通环节的追踪和监控以及保障我国食品安全具有重大意义。
- 我用了一个很复杂的图,帮你们解释下“23版最新北大核心目录有效期问题”。
- 重磅!CSSCI来源期刊(2023-2024版)最新期刊目录看点分析!全网首发!
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?
- 《农业经济》论文投稿解析,难度指数四颗星,附好发选题!
- 期刊知识:学位论文完成后是否可以拆分成期刊论文发表?
- 号外!出书的人注意啦:近期专著书号有空缺!!

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



