不同季铵盐作用下的CO2水合物相平衡
引 言
通过资源化利用的方式来消减CO2气体排放,是应对全球气候变化、实现碳中和目标的重要途径之一[1-2]。CO2气体水合物是一种由水和CO2在特定环境下生成的类冰固体,具有独特的热力学性质和较高的储冷能力,在海水淡化、沼气纯化、空调蓄冷、CO2捕集和海底封存等领域都表现出了巨大潜力[3-5]。但自然状态下CO2气体水合物的生成条件较为苛刻(一般高于2.5 MPa,小于10℃),生成速率十分缓慢,严重阻碍了水合物技术的应用和推广。热力学促进剂可以通过其与水分子相互作用生成水合物笼的方式来增大水合物的生成推动力,进而改善水合物相平衡条件[6-7]。
目前在国内外研究较多的热力学促进剂中有一类是季铵盐类添加剂,因其易与水分子结合,促进水合成笼,从而使得CO2水合物在较为缓和的温度、压力范围内快速生成。Sun等[8]测定了四丁基氯化铵(TBAC) + 二氧化碳 + 水混合物的水合物平衡条件,发现TBAC的存在降低了二氧化碳双水合物的形成压力。Mohammadi等[9]探究了TBAC对气体水合物相平衡条件的影响,结果表明在TBAC质量分数为5%、15%和22%时能显著缓和水合物的形成和解离条件,并且从5%增加到22%时,促进作用增强。Wang等[10]研究了CO2和四丁基溴化磷(TBPB)水合物的相平衡行为,在10%、20%、30%、37%(质量)的TBPB下生成水合物,可有效降低所需的压力,但水合物的形成也表现为过冷程度较大和诱导延迟时间较长。Mayoufi等[11]测定了TBPB + CO2 + 水体系的相平衡数据,结果表明,在低浓度(摩尔分数0.0058)的水中加入TBPB后,281.6 K下CO2水合物的生成压力降至0.5 MPa,而在相同温度下,在没有促进剂的情况下,生成压力降至3.5 MPa。Wang等[12]通过对四正丁基溴化铵(TBAB)、TBPB和TBAB + TBPB与CO2作用下半水合物的生成动力学研究,表明在一定过冷条件下,TBAB + TBPB溶液的CO2吸收大于TBAB和TBPB溶液,TBAB+TBPB溶液能提高水合物生成动力学和CO2储存能力。Ye等[13]测定了在压力0.3~4.4 MPa和温度279~292 K条件下CO2 + TBAB水合物的平衡数据,发现质量分数在0.05~0.32时,平衡温度在一定压力下升高。Fan等[14]采用水合物分离法在281.3 K条件下对67.00%(mol)CH4/CO2混合气体与TBAB溶液进行CO2捕集,发现TBAB的加入增大了CO2的捕集效率。Chima-Maceda等[15]采用恒容压力搜索法测定了1-丙醇/TBAB水溶液中二氧化碳在正己烷存在下的水合物平衡条件,结果表明,1-丙醇对CO2 + 正己烷水合物具有热力学抑制作用,而TBAB被证明是一种强有力的热力学促进剂。
近年来,国内外关于水合物热力学促进剂的研究[16-18]主要集中在以下两个方面:一是通过实验测定不同水合物的生成条件及其所对应的三相平衡点;二是通过对比不同添加剂的促进效果,尝试寻找一种能够降低水合物生成能耗的新型、高效、环保、经济的水合物促进剂。实际上,在实施热力学强化水合物生成过程中,不同气体、不同促进剂所生成气体水合物的相平衡条件都有所不同[19],因此,必须对不同促进剂作用下的CO2水合物相平衡特征进行深入研究。考虑到物质组成、分子结构及理化性质的差异,本文以四丁基氟化铵(TBAF)、四丁基氯化铵(TBAC)、四丁基溴化铵(TBAB)、苄基三乙基氯化铵(TEBAC)为研究对象,探究了其对CO2气体水合物相平衡条件和稳定性的影响。
1 实验部分
1.1 主要原料
实验过程中所使用的CO2气体是由南京特种气体有限公司提供,纯度为高纯(体积分数为99.99%),主要试剂如表1所示。
表1 实验试剂
Table 1
| 试剂 | 分子式 | 纯度 | 供应商 |
|---|---|---|---|
| 四丁基氟化铵(TBAF) | C₁₆H₃₆FN | 0.98 | 上海阿拉丁试剂晶纯实业有限公司 |
| 四丁基氯化铵(TBAC) | C₁₆H₃₆ClN | 0.99 | 上海阿拉丁试剂晶纯实业有限公司 |
| 四丁基溴化铵(TBAB) | C₁₆H₃₆BrN | 0.99 | 上海阿拉丁试剂晶纯实业有限公司 |
| 苄基三乙基氯化铵(TEBAC) | C13H22ClN | 0.99 | 上海阿拉丁试剂晶纯实业有限公司 |
| 去离子水 | H2O | — | 实验室自制 |
1.2 实验设备与流程
鉴于CO2气体水合物生成过程中相态转变的复杂性,采用恒容温度搜索法[20-21],通过低温高压装置,分别测定了不同季铵盐促进剂作用下CO2气体水合物的相平衡数据。该实验装置主要由CO2气体钢瓶、恒温水浴槽、搅拌设备、可视高压平衡釜以及数据采集记录系统五部分组成,如图1所示。其中,可视高压相平衡釜的主体材质为316 L不锈钢(设计压力为25 MPa,体积为220 ml),内置机械搅拌装置(最高转速为1440 r/min),整体浸没在恒温水浴槽中。平衡釜配有一个0.5%扩散硅芯片压力传感器(±1 kPa)和两个Pt-100铂金电阻温度传感器(±0.1 K),主要用于采集釜内压力、液相温度、气相温度等数据,并通过传感器将模拟信号转换为数字信号,传输给计算机实时记录保存实验数据。
图1
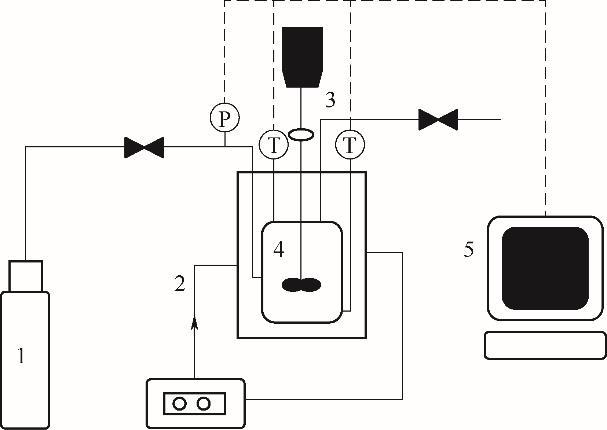
图1 实验装置图
1—CO2气体瓶;2—恒温水浴槽;3—搅拌装置;4—可视高压平衡釜;5—数据采集记录系统
Fig.1 Diagram of experimental device
水合物生成过程:设定初始温度,开启实验数据采集及记录系统,实时记录压力、温度的变化;将季铵盐水溶液置于平衡釜中,缓慢充入CO2气体至实验压力,打开搅拌,开始降温,待釜内压力迅速降低时,说明此时水合物大量生成,停止降温。
水合物分解过程:水合物生成约4 h后,逐步升温并实时观察水合物形态和数量变化,直至水合物完全分解,体系恢复为气液两相。此时,水合物生成/分解图中的交点温度即为其所对应的压力下的水合物相平衡温度。重复上述步骤三次,以平均值来确定水合物相平衡点。重新设定压力,重复上述过程,即可得到其他相平衡点数据。
1.3 水合物相平衡点的确定
考虑到水合物生成过程中需要较高的过冷度和较长的诱导时间[22-23],为准确测定水合物相平衡数据,需要通过水合物完全分解点来确定气-液-固三相相平衡点[24-25]。本文采用恒容温度搜索法,测定了水合物生成和分解过程中的温度压力(P-T)变化关系,如图2所示。可以看出,水合物生成初始阶段,随着温度的降低,平衡釜内压力连续降低,压力随温度变化的曲线无明显拐点(曲线AB)。随着水合物的不断生成,平衡釜内压力持续下降,出现拐点B后,系统压力迅速降低,说明此时水合物大量生成(曲线BC)。在分解过程中,水合物需要吸收大量热量[26],因此初始升温时,釜内压力变化不大(曲线CD)。但随着温度的不断升高,压力不断增大(曲线DE),直至出现P-T相图的交点E,即为水合物的气-液-固三相相平衡点。透过平衡釜可视窗口,可以清晰观察到水合物在生成与分解过程中的状态和数量变化,如图3所示。其中,图3(a)实验初始阶段,气液界面明显,未见有固体生成;图3(b)随着温度的进一步降低,类冰状水合物开始生成,系统处于固液共存状态;图3(c)保持低温状态不变,水合物不断生成,基本观察不到液相的存在;图3(d)随着温度的不断升高,固体水合物随之分解;图3(e)水合物完全分解,体系恢复为气液两相。
图2
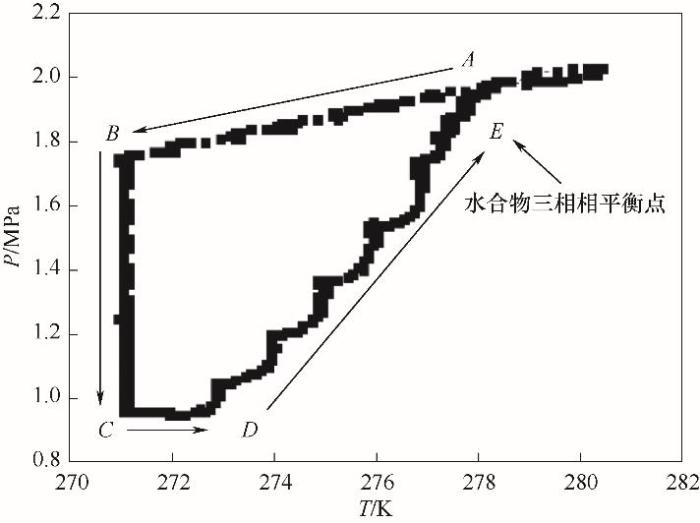
图2 CO2气体水合物生成及分解过程P-T曲线
A→B降温过程阶段;B→C恒温水合物生成阶段;C→D水合物维持阶段;D→E水合物分解阶段
Fig.2 P-T curve of formation and decomposition process of CO2 hydrate
图3

图3 CO2气体水合物形成过程
Fig.3 CO2 hydrate formation process
2 结果与讨论
2.1 数据计算及可靠性验证
2.1.1 实验数据计算
(1)平均驱动力
水合物生成的平均驱动力
其中,n是数据点的数量,
(2)相变潜热的计算
水合物相变潜热是气体水合物生成或分解过程中放出或吸收的单位热量,通常采用Clausius-Clapeyron方程来计算[28],如
其中,P、T分别为气体水合物生成时的相平衡压力和温度;R为气体常数(8.314 J·mol-1·K-1);Z为气体压缩因子,通过PR方程计算;
该方程假设0℃以上时,气体水合物的生成相变潜热
2.1.2 实验可靠性验证
为验证装置的可靠性,实验测定了CO2气体水合物的相平衡数据,并将其与文献数据[27-28, 32-33]进行对比,如图4所示。可以看出,实验值与文献值吻合良好,相对误差不超过3%,说明恒容温度搜索法可以准确测定CO2气体水合物的相平衡数据。
图4

图4 CO2水合物相图
Fig.4 Phase diagram of CO2 gas hydrate
2.2 季铵盐对CO2水合物相平衡的影响
季铵盐热力学促进剂(TBAF、TBAC、TBAB、TEBAC)作用下的CO2水合物相平衡数据列于表2、图5、图6。其中,Ted、Ped分别为气-液-固三相平衡时的温度和压力,
表2 促进剂作用下CO2水合物相平衡条件
Table 2
| 促进剂 | 5%(质量) | 7%(质量) | 10%(质量) | 12%(质量) | 15%(质量) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ted/K | Ped/MPa | ΔTave/K | Ted/K | Ped/MPa | ΔTave/K | Ted/K | Ped/MPa | ΔTave/K | Ted/K | Ped/MPa | ΔTave/K | Ted/K | Ped/MPa | ΔTave/K | |
| TBAF | 284.25 | 0.44 | 11.00 | 285.35 | 0.65 | 11.65 | 286.35 | 0.86 | 12.95 | 286.85 | 0.8 | 13.40 | 287.35 | 0.74 | 13.65 |
| 287.55 | 1.34 | 287.95 | 1.38 | 288.25 | 1.41 | 289.05 | 1.38 | 289.75 | 1.35 | ||||||
| 288.75 | 1.95 | 289.05 | 1.92 | 289.35 | 1.9 | 290.35 | 1.98 | 291.35 | 2.06 | ||||||
| 289.45 | 2.46 | 289.85 | 2.46 | 290.25 | 2.46 | 291.25 | 2.56 | 292.25 | 2.63 | ||||||
| 289.85 | 2.76 | 290.55 | 2.92 | 291.25 | 3.03 | 292.85 | 3.35 | 294.35 | 3.68 | ||||||
| 290.75 | 3.45 | 291.45 | 3.51 | 292.15 | 3.57 | 293.35 | 3.67 | ||||||||
| TBAC | 273.35 | 0.78 | 2.20 | 277.85 | 0.92 | 4.35 | 281.75 | 1.07 | 6.95 | 281.35 | 0.71 | 7.85 | 280.95 | 0.35 | 8.15 |
| 276.65 | 1.29 | 280.05 | 1.38 | 282.85 | 1.46 | 282.95 | 1.06 | 282.95 | 0.65 | ||||||
| 278.65 | 1.75 | 281.45 | 1.8 | 283.65 | 1.86 | 283.85 | 1.43 | 284.05 | 1.01 | ||||||
| 280.55 | 2.12 | 283.05 | 2.29 | 284.85 | 2.46 | 285.15 | 2.12 | 285.45 | 1.74 | ||||||
| 281.75 | 2.48 | 284.15 | 2.87 | 285.65 | 3.25 | 286.15 | 2.88 | 286.65 | 2.51 | ||||||
| 282.75 | 2.91 | 285.05 | 3.41 | 286.75 | 3.91 | 287.15 | 3.58 | 287.45 | 3.25 | ||||||
| 283.65 | 3.36 | 286.15 | 3.97 | 288.05 | 4.28 | 288.65 | 4.19 | ||||||||
| TBAB | 279.45 | 0.42 | 6.35 | 281.05 | 0.57 | 7.45 | 282.05 | 0.36 | 9.60 | 283.55 | 0.43 | 9.85 | 283.05 | 0.49 | 10.30 |
| 281.45 | 0.71 | 282.45 | 0.81 | 284.85 | 0.84 | 284.65 | 0.66 | 284.45 | 0.86 | ||||||
| 282.75 | 1.31 | 284.45 | 1.31 | 285.35 | 1.03 | 285.55 | 0.98 | 285.75 | 1.16 | ||||||
| 284.05 | 1.73 | 285.65 | 1.62 | 286.45 | 1.52 | 286.55 | 1.42 | 286.65 | 1.52 | ||||||
| 284.45 | 1.98 | 286.55 | 2.36 | 287.05 | 2.03 | 287.45 | 2.07 | 287.75 | 2.12 | ||||||
| 285.45 | 2.45 | 287.15 | 2.67 | 287.65 | 2.61 | 288.15 | 2.62 | 288.35 | 2.53 | ||||||
| 286.05 | 2.91 | 287.55 | 3.08 | 288.35 | 3.25 | 288.75 | 3.23 | 289.05 | 3.12 | ||||||
| 286.75 | 3.57 | 287.95 | 3.54 | 288.85 | 3.87 | 289.15 | 3.7 | 289.45 | 3.53 | ||||||
| 287.05 | 4.07 | 288.25 | 3.82 | 289.45 | 4.32 | 289.55 | 4.22 | 289.85 | 4.12 | ||||||
| 287.25 | 4.23 | 288.75 | 4.36 | ||||||||||||
| TEBAC | 272.75 | 1.13 | 0.25 | 273.85 | 1.23 | 0.55 | 274.95 | 1.33 | 0.75 | 274.25 | 1.22 | 0.95 | 273.45 | 1.07 | 1.15 |
| 276.25 | 1.75 | 276.45 | 1.74 | 276.65 | 1.73 | 276.15 | 1.65 | 275.65 | 1.57 | ||||||
| 278.35 | 2.24 | 278.45 | 2.14 | 278.45 | 2.04 | 278.25 | 1.98 | 278.05 | 1.92 | ||||||
| 279.45 | 2.75 | 279.95 | 2.68 | 280.35 | 2.62 | 280.25 | 2.48 | 279.65 | 2.34 | ||||||
| 280.65 | 3.09 | 281.05 | 3.02 | 281.35 | 2.95 | 281.35 | 2.91 | 281.45 | 2.86 | ||||||
| 281.75 | 3.65 | 281.75 | 3.46 | 281.75 | 3.26 | 282.25 | 3.3 | 282.75 | 3.34 | ||||||
| 282.85 | 4.03 | 283.25 | 3.93 | 283.55 | 3.83 | 283.75 | 3.79 | 283.85 | 3.74 | ||||||
| 285.35 | 4.26 |
图5

图5 季铵盐作用下CO2水合物相平衡条件
Fig.5 Phase equilibrium condition for CO2 hydrate under quaternary ammonium salt action
图6
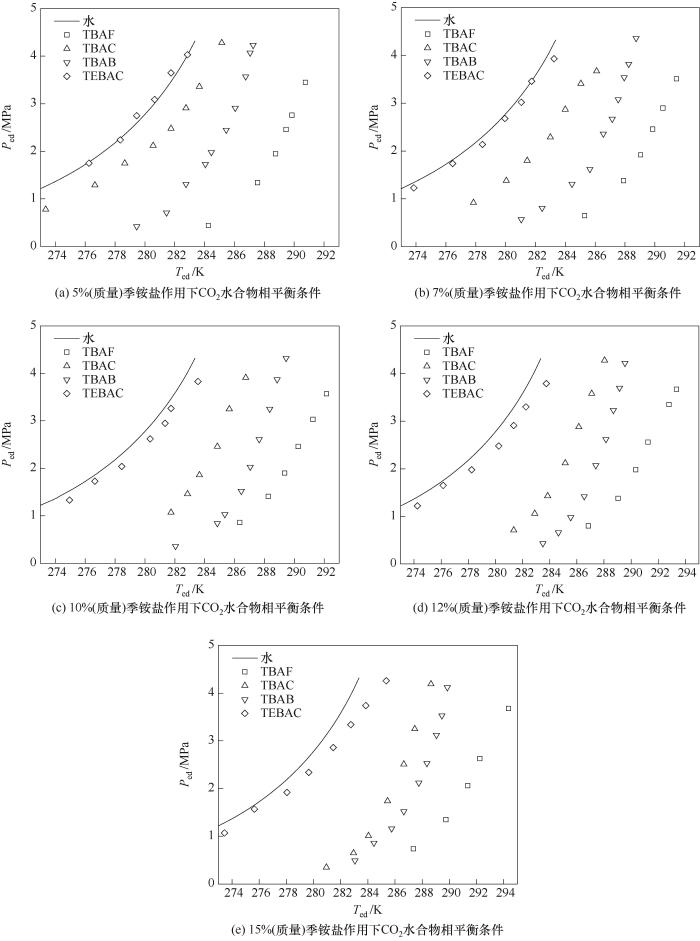
图6 不同质量分数促进剂作用下CO2水合物相平衡条件
Fig.6 Phase equilibrium condition for CO2 hydrate under different accelerant mass fraction
图5(a)~(d)分别给出了不同质量分数条件下TBAF、TBAC、TBAB和TEBAC对CO2水合物的促进效果。可以看出,TBAF、TBAC、TBAB和TEBAC四种季铵盐促进剂都可以扩大水合物的稳定区。相同条件下,随着季铵盐配比浓度的增加,改善CO2水合物相平衡条件的效果呈现出先增后减的趋势,因此热力学促进剂添加量存在最佳值。当季铵盐水溶液质量分数为5%~10%时,随着质量分数的增加,CO2水合物相平衡温度显著升高,其中质量分数为10% TBAF溶液对CO2水合物促进效果最好,平均驱动力∆Tave为12.95 K。当季铵盐水溶液质量分数升高至10%~15%后,随着质量分数的进一步增加,尤其是使用量大于其与水完全生成水合物的理论配比时,过量的四丁基卤化铵将会产生抑制效果,导致促进效果减弱。
图6(a)~(e)分别给出了相同质量分数下TBAF、TBAC、TBAB和TEBAC对CO2水合物的促进效果。可以看出,在相同条件下,CO2气体水合物生成的相平衡温度由高到低分别为:TBAF > TBAB > TBAC > TEBAC,其中TBAF、TBAC、TBAB的促进效果明显高于TEBAC。从微观角度来看,TEBAC分子结构中的苯环占据了较大空间,导致水分子无法在其周围生成活泼水分子簇,进而削弱了CO2气体分子和游离水的迁移程度,因此TEBAC促进效果最差。TBAF分子结构中阴离子F-与CO2分子之间范德华作用力更强,使得CO2更容易进入到不稳定的水合物分子簇中,进而生成稳定的气体水合物,因此TBAF促进效果最为明显。但过量TBAF能够与水生成固体季铵盐水合物,增大CO2进入液相的阻力,进而抑制水合物生成,导致其促进效果减弱。综合考虑促进剂的质量分数、水合物特性以及促进效果,压力范围在0.35~4.50 MPa内,选择质量分数范围在10%~12%内的TBAB作为CO2气体水合物的促进剂。
2.3 季铵盐作用下CO2水合物相变潜热的计算
TBAF、TBAC、TBAB和TEBAC作用下的CO2水合物相变潜热计算结果见表3。可以看出,相同浓度下,CO2水合物相变潜热由大到小分别为:TBAB > TBAF > TBAC > TEBAC,这与由相平衡数据得到季铵盐促进效果的优越性顺序基本一致。其中,TBAB和TBAF作用下CO2水合物相变潜热相接近且明显高于其他季铵盐,说明其促进效果最好,所对应的水合物生成条件也最为温和。同时,TBAF、TBAC和TBAB三种促进剂的斜率计算值在 -28000~-20000之间,进一步说明四丁基季铵盐与水结合能够生成半笼型气体水合物,这与Sun等[8]研究结果相符。TEBAC的斜率计算值大于-10000,说明TEBAC的作用下生成的CO2水合物结构更接近于SⅠ型,与四丁基季铵盐的半笼型水合物存在较大差异。拟合度R2值均大于0.99,说明所测相平衡数据具有很好的线性拟合关系,满足热力学一致性检验原则。此外,TBAC计算偏差较大,为27.73%,这可能是因为TBAC在低浓度时所生成半笼型水合物易受Cl-的影响,使TBAC对CO2气体分子的吸附能力减弱,进而导致低浓度时TBAC作用下的水合物相变潜热较小。
表3 季铵盐作用下CO2水合物的相变潜热
Table 3
| 促进剂 | 质量分数/% | Aslope | ΔHd /(kJ·mol-1) | R2 |
|---|---|---|---|---|
| TBAF | 5 | -23641 | 163.51 | 0.9937 |
| 7 | -23457 | 167.52 | 0.9975 | |
| 10 | -28785 | 205.49 | 0.9944 | |
| 12 | -23947 | 171.12 | 0.9927 | |
| 15 | -24775 | 175.54 | 0.9972 | |
| TBAC | 5 | -10925 | 74.75 | 0.9930 |
| 7 | -20674 | 126.89 | 0.9948 | |
| 10 | -21348 | 147.98 | 0.9946 | |
| 12 | -22486 | 156.40 | 0.9959 | |
| 15 | -27154 | 194.80 | 0.9951 | |
| TBAB | 5 | -26843 | 198.50 | 0.9985 |
| 7 | -25296 | 181.37 | 0.9923 | |
| 10 | -24526 | 178.82 | 0.9961 | |
| 12 | -23530 | 174.14 | 0.9982 | |
| 15 | -23850 | 172.88 | 0.9910 | |
| TEBAC | 5 | -8882.8 | 59.05 | 0.9942 |
| 7 | -9704.5 | 64.49 | 0.9973 | |
| 10 | -9588.2 | 63.06 | 0.9952 | |
| 12 | -9162.1 | 61.96 | 0.9956 | |
| 15 | -9904.5 | 65.37 | 0.9973 |
2.4 气-液-固三相平衡数据的计算
气体水合物的相平衡条件是衡量其能否稳定存在的重要标准,本文利用Chen-Guo模型[35],结合PR状态方程[36]和改进Joshi经验活度模型[37],分别对TBAF、TBAB、TBAC和TEBAC作用下CO2气体水合物热力学相平衡数据进行了计算。
2.4.1 Chen-Guo热力学模型
气体水合物相平衡条件预测模型多是基于范德瓦尔-普朗特[38]统计热力学基本模型发展而来的,但计算结果始终存在较大误差。不同于范德单吸附机理的水合物形成/分解机理,Chen-Guo模型认为水合物成核过程中同时进行着以下两种动力学过程:准化学反应动力学过程和吸附动力学过程。因此,在对各类气体水合物体系的相平衡条件进行预测时,Chen-Guo模型的计算结果与实验数值符合得更好。方程形式如下:
式中,
2.4.2 PR状态方程
气相逸度的计算结果会直接影响气体水合物相平衡数据的预测精度。现有研究表明[39],PR状态方程更适合用于预测CO2气体水合物相平衡条件。方程形式如下:
2.4.3 改进Joshi经验活度模型
Greenspan等[40]认为液相活度与促进剂的浓度、系统的温度、压力相关。促进剂浓度和系统温度对水合物活度影响比较大,而压力变化对活度的影响比较小。因此,本文采用Joshi等[37]提出的液相活度
式中,
表4 拟合参数K1和K2
Table 4
| 促进剂 | 质量分数/% | K1 | K2 |
|---|---|---|---|
| TBAF | 5 | -2.219 | -653 |
| 10 | -1.445 | -431.4 | |
| 15 | -1.299 | -393.2 | |
| TBAC | 5 | -0.2616 | -74.94 |
| 10 | -1.512 | -435.9 | |
| 15 | -2.313 | -670.8 | |
| TBAB | 5 | -1.868 | -539 |
| 10 | -2.472 | -719.9 | |
| 15 | -1.968 | -576.4 | |
| TEBAC | 5 | -0.108 | -28.48 |
| 10 | -0.05776 | -15.57 | |
| 15 | 0.03457 | 9.756 |
图7(a)~(d)给出了不同温度条件下,TBAF、TBAB、TBAC和TEBAC作用下CO2气体水合物的相平衡压力。可以看出,计算值与实验值的一致性较高,相平衡压力计算值和实验值之间最大平均相对误差为7.50%,说明Chen-Guo模型结合改进Joshi经验活度模型能够很好地预测季铵盐热力学促进剂作用下的CO2水合物相平衡数据。
图7
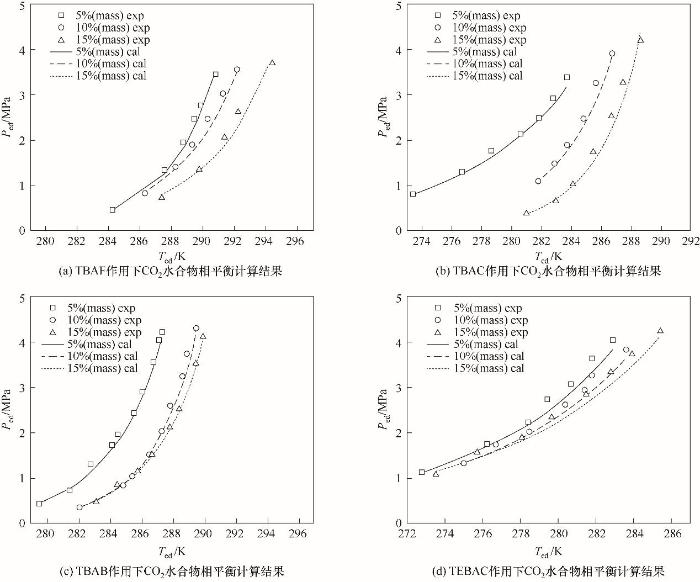
图7 季铵盐作用下CO2水合物相平衡计算结果
Fig.7 Phase equilibrium calculation results for CO2 hydrate under quaternary ammonium salt action
3 结 论
(1)设计并搭建一套高压低温水合物相平衡的实验装置,采用恒容温度搜索法,探讨了在压力0.35~4.50 MPa和温度272.75~294.35 K范围内,四种季铵盐促进剂对CO2气体水合物相平衡特征的影响。结果表明,随着促进剂浓度增加,CO2水合物的相平衡条件向高温、低压区域转移。相同条件下,促进剂作用下CO2水合物的相平衡温度由高到低分别是:TBAF > TBAB > TBAC > TEBAC。
(2)基于Clausius-Clapeyron方程,计算了不同体系的相变潜热,并探讨了其对水合物稳定性的影响。可以看出,相同条件下,对于季铵盐促进剂,稳定性由高到低:TBAB > TBAF > TBAC >TEBAC。其中TBAB、TBAF的计算相变潜热相接近,说明其稳定性相似。
(3)利用Chen-Guo模型,结合 PR 状态方程和改进Joshi 经验活度模型,分别计算了TBAF、TBAB、TBAC和TEBAC作用下CO2水合物热力学相平衡数据,计算结果与实验结果吻合良好,最大平均相对误差为7.50%。
- 我用了一个很复杂的图,帮你们解释下“23版最新北大核心目录有效期问题”。
- 重磅!CSSCI来源期刊(2023-2024版)最新期刊目录看点分析!全网首发!
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?
- 《农业经济》论文投稿解析,难度指数四颗星,附好发选题!
- 期刊知识:学位论文完成后是否可以拆分成期刊论文发表?
- 号外!出书的人注意啦:近期专著书号有空缺!!

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



