低氮源培养对鼠李糖乳杆菌胁迫耐受能力的影响
益生菌具有维持肠道菌群稳定、调节免疫、产生有益物质、抑制病原微生物等益生作用[1]。其中乳酸菌及其发酵乳制品已成为目前最受欢迎的功能食品[2],近年来在国内亦受到越来越多的关注。
活性是乳酸菌在食品中进行发酵和在人体内发挥益生作用的必要基础。研究人员认为食品中益生菌的活菌数达到106~107 CFU/g,日摄入量达到109 CFU方能发挥较好的益生功能[3]。然而,乳酸菌在生产、贮藏、运输和消费过程中,会遭受来自于工艺流程、宿主、及自身代谢所产生的多种胁迫,产生严重的活性损失[4]。因此,如何提高乳酸菌的胁迫耐受能力是重要的研究课题。
鼠李糖乳杆菌(Lactobacillus rhamnosus)hsryfm 1301分离自中国巴马的长寿老人,具有显著功能特性[5]。该菌株对热胁迫和氧化胁迫存在明显的交叉适应[6]。将鼠李糖乳杆菌hsryfm 1301分别在热胁迫或氧化胁迫条件下进行转录组-表型匹配,发现多达32个寡肽转运、肽酶和氨基酸代谢等氮代谢相关基因受到下调;进一步研究显示,低氮源环境下培养的鼠李糖乳杆菌具有更强的热胁迫和氧化胁迫耐受能力[7]。降低培养环境中的氮源浓度有助于鼠李糖乳杆菌耐受生产过程(如喷雾干燥)中的热胁迫和氧化胁迫。另一方面,氨基酸在乳酸菌的酸胁迫、胆盐胁迫和渗透压胁迫等的耐受中发挥积极作用[4, 8]。因此,氮源浓度的降低是否会影响菌株对其他胁迫的耐受尚未可知。
氮源作为所有培养基都不可或缺的成分,其含量对胁迫耐受的影响不容忽视。本文主要探究鼠李糖乳杆菌hsryfm 1301在低氮源环境下的胁迫耐受变化,以期提高菌株在生产中的胁迫耐受能力。
1 材料与方法
1.1 菌株
鼠李糖乳杆菌hsryfm 1301于2013年分离自广西省巴马瑶族自治县的长寿老人,具有显著的降血脂功能[5],中国普通微生物菌种保藏管理中心(CGMCC No.8545)。
1.2 材料与试剂
胃蛋白酶(1∶10 000)、牛胆盐,北京索莱宝科技有限公司;2×Taq PCR MasterMix,宝日医生物技术有限公司。
MRS培养基(g/L):蛋白胨10.0、牛肉浸粉8.0、酵母浸粉4.0、葡萄糖20.0、磷酸氢二钾2.0、柠檬酸氢二铵2.0、乙酸钠5.0、硫酸镁0.2、硫酸锰0.04、吐温80 1.0,pH(6.5±0.2)。
不同氮源浓度的MRS培养基通过添加不同量的胰蛋白胨进行调整(表1)[7]。
表1 不同氮源浓度培养基中胰蛋白胨的浓度
Table 1 Concentrations of tryptone peptone in the modified MRS media

人工胃液:氯化钠5.0 g/L、胃蛋白酶3.0 g/L,用1 mol/L的HCl调节pH至2.5。
胆盐培养基:准确称取一定量的胆盐溶于MRS液体培养基中,使其胆盐质量浓度为1 g/L,用0.1 mol/L HCl调节pH(6.5±0.2),高压灭菌后(121 ℃,15 min),冷却备用。
1.3 仪器与设备
Biophotometer plus核酸蛋白测定仪、5424R台式冷冻离心机,艾本德中国有限公司;JF-SX-500全自动灭菌锅,日本TOMY公司;SW-CJ-1F超净工作台,苏州净化设备有限公司;SPX-150BSH生化培养箱,上海新苗医疗器械制造有限公司;DNA水平电泳槽,北京六一生物科技有限公司;蓝光透射仪,天根生化科技(北京)有限公司。
1.4 实验方法
1.4.1 菌株的培养与鉴定
从冻存管中取鼠李糖乳杆菌hsryfm 1301的冻干菌粉(约1.0 g),置于10 mL MRS液体培养基,37 ℃培养24 h;将菌液在MRS固体培养基上划线纯化;挑取单菌落,在MRS液体培养基37 ℃培养24 h;4 ℃保藏备用。
将活化好的鼠李糖乳杆菌hsryfm 1301按2%(体积分数)的接种量转接到新鲜MRS液体培养基中,37 ℃培养12 h。然后4 ℃,6 000×g离心10 min收集菌体。利用细菌基因组DNA提取试剂盒(生工生物工程(上海)股份有限公司)提取菌株的DNA,使用鼠李糖乳杆菌hsryfm 1301的菌株鉴定引物进行扩增,并与母株扩增图谱进行比较[9]。
1.4.2 生长能力比较
将活化好的鼠李糖乳杆菌hsryfm 1301按2%的接种量分别转接到含不同氮源浓度的MRS液体培养基中,放置37 ℃培养箱中静置培养,每隔1 h测1次OD600值,记录不同培养基菌体OD600值到达0.5、1.0、2.0、3.0和4.0时的时间,每次测定平行3次。
1.4.3 活菌数测定
将处理样品10倍梯度稀释于MRS液体培养基,滴注5 μL稀释液于MRS固体培养基,37 ℃培养24~48 h;选择菌落数在30~200(稀释梯度为Tdilution)的菌斑计数为Ncolony。CFU计算方法:CFU/mL=10Tdilution×200×Ncolony[10]。
1.4.4 热胁迫存活率测定
将活化好的鼠李糖乳杆菌hsryfm 1301按2%的接种量分别转接到9支0P MRS和MRS培养基中,37 ℃ 静置培养至OD600值达到0.5。然后3支直接进行热胁迫(54 ℃,1 h)处理;3支先经温和热胁迫(46 ℃,1 h)预处理,再进行热胁迫(54 ℃,1 h)处理;3支先经温和氧化胁迫(0.5 mmol/L H2O2,1 h)预处理,再进行热胁迫(54 ℃,1 h)处理;分别测定处理前后的活菌数[6]。
1.4.5 氧化胁迫存活率测定
将活化好的鼠李糖乳杆菌hsryfm 1301按2%的接种量分别转接到9支0P MRS和MRS培养基中,37 ℃ 静置培养至OD600值达到0.5。然后3支直接进行氧化胁迫(2.0 mmol/L H2O2,1 h)处理;3支先经温和热胁迫(46 ℃,1 h)预处理,再进行氧化胁迫(2.0 mmol/L H2O2,1 h);3支先经温和氧化胁迫(0.5 mmol/L H2O2,1 h)预处理,再进行氧化胁迫(2.0 mmol/L H2O2,1 h);分别测定处理前后的活菌数[6]。
1.4.6 不同生长阶段耐热和耐氧化胁迫能力的测定
将活化好的鼠李糖乳杆菌hsryfm 1301按2%的接种量分别转接到0P MRS和 MRS培养基中,37 ℃静置培养至OD600值达到0.5、1.0、2.0、3.0、4.0,然后每个阶段分别进行热胁迫(54 ℃,1 h)和氧化胁迫(1.6 mmol/L H2O2,1 h)处理,并测定每个阶段经热胁迫和氧化胁迫后的活菌数。
1.4.7 菌株对模拟胃肠道环境耐受能力的测定
将活化好的鼠李糖乳杆菌hsryfm 1301按2%的接种量接种到MRS液体培养基中,37 ℃培养至OD600值达到2.0左右,离心收集菌体,用灭菌的PBS缓冲液将菌体洗涤2次后悬浮,取1.0 mL的菌悬液接种至9.0 mL的pH 2.5人工胃液,37 ℃培养3 h,分别在0和3 h利用平板计数法测定活菌数,计算其存活率(%)。每组重复3次。
将活化好的鼠李糖乳杆菌hsryfm 1301按2%的接种量接种到MRS液体培养基中,37 ℃培养至OD600值达到2.0左右,离心收集菌体,用灭菌的PBS缓冲液将菌体洗涤2次后悬浮,取1.0 mL的菌悬液接种至9.0 mL的0.1%胆盐的MRS培养基中,37 ℃培养3 h,分别在0和3 h用平板计数法测定活菌数,计算其存活率(%)。每组重复3次。
1.4.8 菌株对高渗透压和低温胁迫的耐受能力的测定
将活化好的鼠李糖乳杆菌hsryfm 1301按2%的接种量接种到MRS液体培养基中,37 ℃培养至OD600值达到2.0左右,离心收集菌体,用添加80 g/L NaCl的MRS培养基重悬,37 ℃培养4 h,分别在0和4 h用平板计数法测定活菌数,计算其存活率(%)。每组重复3次。
将活化好的鼠李糖乳杆菌hsryfm 1301按2%的接种量接种到MRS液体培养基中,37 ℃培养至OD600值达到2.0左右,取1 mL菌液冻存于-20 ℃,分别在0和24 h用平板计数法测定活菌数,计算其存活率(%)。每组重复3次。
1.4.9 数据统计与处理
采用SPSS 19.0软件对实验数据进行显著性分析。
2 结果与分析
2.1 鼠李糖乳杆菌hsryfm 1301在低氮源条件下的生长能力
使用鼠李糖乳杆菌hsryfm 1301的菌株鉴定引物对活化菌株的DNA进行扩增,获得的扩增图谱与母株扩增图谱一致(图1-A、图1-B)[10],表明纯化获得的菌株即为鼠李糖乳杆菌hsryfm 1301,实验数据可与前期数据进行对比。
低氮源环境下培养的鼠李糖乳杆菌具有更强的热胁迫和氧化胁迫耐受能力[7],但是氮源浓度同时会影响鼠李糖乳杆菌hsryfm 1301的生长能力。菌株在4种培养基中,OD600值均能在4 h达到1.0;在OD600值达到2.0之前,氮源浓度对鼠李糖乳杆菌hsryfm 1301的生长速度影响不大。随着菌体的继续生长,氮源开始成为限制因素,鼠李糖乳杆菌hsryfm 1301的OD600值在0P MRS中达到3.0和4.0的时间均显著晚于MRS培养基(超过1 h)(图1-C)。值得注意的是,鼠李糖乳杆菌hsryfm 1301的OD600值在0P MRS中最先到达0.5,在2P MRS中最迟到达 2.0,表明高浓度氮源能够抑制菌株生长。在实际生产中应随生长时期调整氮源浓度,以促进菌株的生长。
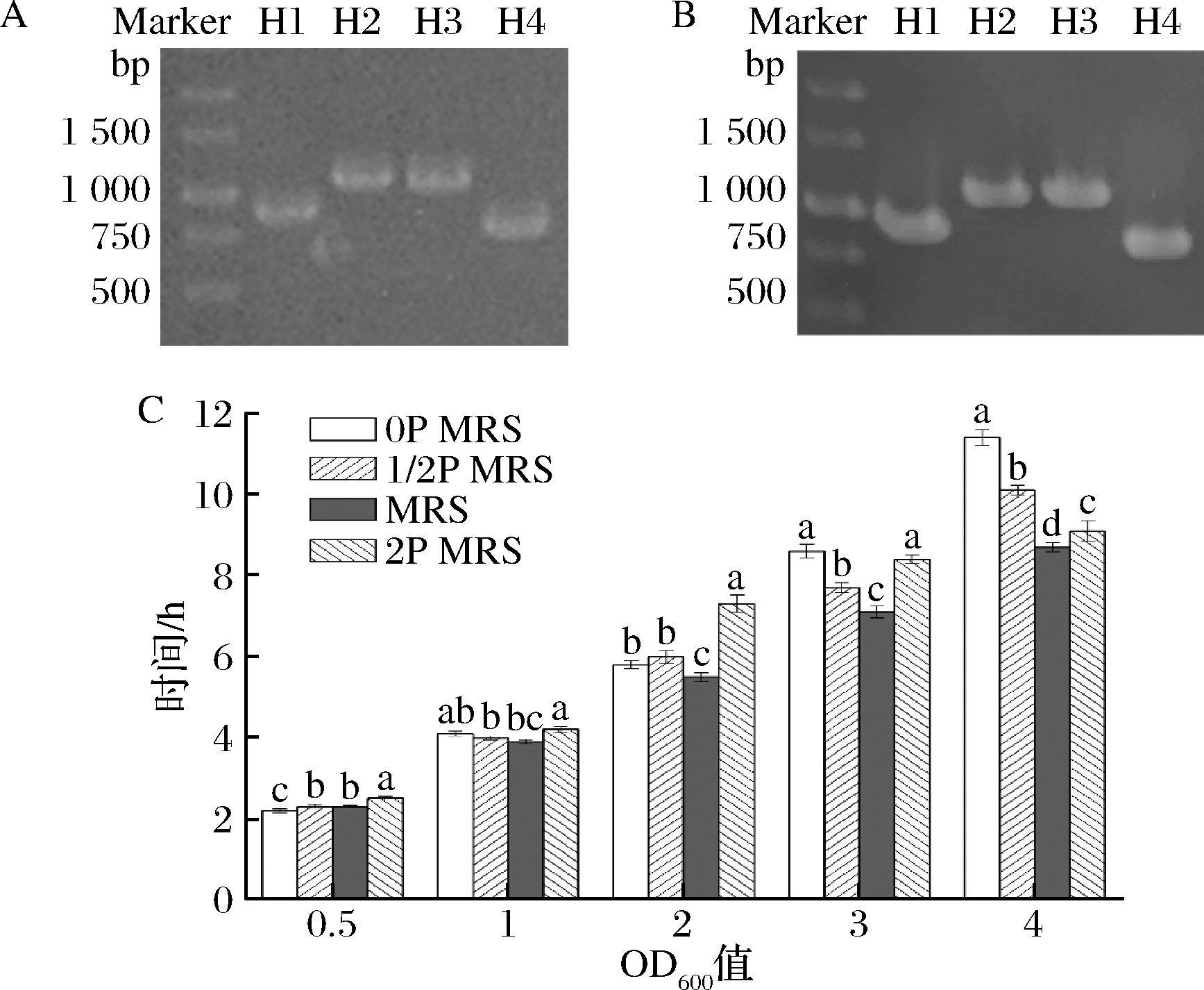
A-特异性引物对实验菌株的扩增图谱(H1~H4为鼠李糖乳杆菌 hsryfm 1301的特异性扩增引物对);B-特异性引物对鼠 李糖乳杆菌hsryfm 1301母株的扩增图谱;C-鼠李糖乳杆菌 hsryfm 1301在不同浓度氮源培养基中生长至特定浓度的时间
图1 鼠李糖乳杆菌hsryfm 1301在不同浓度氮源培养基中的 生长情况
Fig.1 Growth of L.rhamnosus hsryfm 1301 in media containing different concentrations of tryptone peptone 注:图中不同小写字母表示差异显著(P<0.05)(下同)
2.2 鼠李糖乳杆菌hsryfm 1301在低氮源培养下的热胁迫-氧化胁迫交叉适应
鼠李糖乳杆菌hsryfm 1301在MRS中对热胁迫和氧化胁迫存在显著的交叉适应[6]。同种胁迫预处理能够将菌株的胁迫耐受能力提高至将近90%以上;氧化预处理能够将菌株的热胁迫存活率从1%提高至46%(图2-A),而热预处理能够将菌株的氧化胁迫存活率从2%提高至20%(图2-B)。这一特性有助于菌株耐受喷雾干燥等生产过程中的胁迫环境。
在0P MRS中,鼠李糖乳杆菌hsryfm 1301对热胁迫和氧化胁迫的适应能力大幅提升,分别达到39%和35%;同种胁迫预处理能够将菌株的胁迫耐受能力进一步提升至80%以上(图2-C~图2-D)。而且氧化预处理使热胁迫的耐受能力提高至96%(图2-C),热预处理使氧化胁迫的耐受能力提高至69%(图2-D)。因此,热-氧化胁迫交叉适应仍然存在,虽然由于基础耐受能力的上升导致了胁迫耐受提升倍数的下降,但是交叉适应获得的胁迫耐受绝对值进一步提升。表明,氮源降低是实现热-氧化胁迫交叉适应的重要原因,但不是唯一原因;在实际生产中可以通过胁迫预处理和氮源调整进一步提高鼠李糖乳杆菌的热胁迫和氧化胁迫耐受能力。

A-MRS中热预处理(46 ℃,1 h)和氧化预处理(0.5 mmol/L H2O2,1 h)对菌株热胁迫(54 ℃,1 h)耐受能力的影响;B-MRS中热预处理 (46 ℃,1 h)和氧化预处理(0.5 mmol/L H2O2,1 h)对菌株氧化胁迫(2.0 mmol/L H2O2,1 h)耐受能力的影响;C-0P MRS中 热预处理(46 ℃,1 h)和氧化预处理(0.5 mmol/L H2O2,1 h)对菌株热胁迫(54 ℃,1 h)耐受能力的影响;D-0P MRS中热预处理 (46 ℃,1 h)和氧化预处理(0.5 mmol/L H2O2,1 h)对菌株氧化胁迫(2.0 mmol/L H2O2,1 h)耐受能力的影响
图2 鼠李糖乳杆菌hsryfm 1301在MRS和0P MRS中的热-氧化胁迫交叉适应
Fig.2 The heat-oxidative stress cross adaptation of L.rhamnosus hsryfm 1301 in MRS and 0P MRS
2.3 低氮源环境下生长时期对菌株热胁迫和氧化胁迫耐受能力的影响
前期研究在OD600=0.5的条件下发现了鼠李糖乳杆菌hsryfm 1301的热-氧化胁迫交叉适应现象,并通过转录组学分析发现了降低氮源对热胁迫和氧化胁迫耐受能力的提升作用[6-7],但是低氮源在其他生长时期的影响作用尚不清晰。将鼠李糖乳杆菌hsryfm 1301分别在MRS和0P MRS中培养至OD600值达到0.5、1.0、2.0、3.0和4.0,并检测菌体的热胁迫和氧化胁迫耐受能力。
如图3所示,鼠李糖乳杆菌hsryfm 1301在不同生长阶段表现出不同的耐热能力。当菌株生长至OD600值为0.5、1.0、2.0和3.0时,0P MRS菌体的热胁迫存活率均高于正常MRS组。尤其当OD600值达到2.0时,0P MRS组的存活率为73.7%,而MRS为0.57%,低氮源培养(0P MRS)后的存活率提高了129倍(图3-A)。这表明在菌株的生长前期低氮源浓度培养有利于提高其耐热能力。当OD600值达到4.0时,对照组的存活率与0P MRS组无显著性差异。
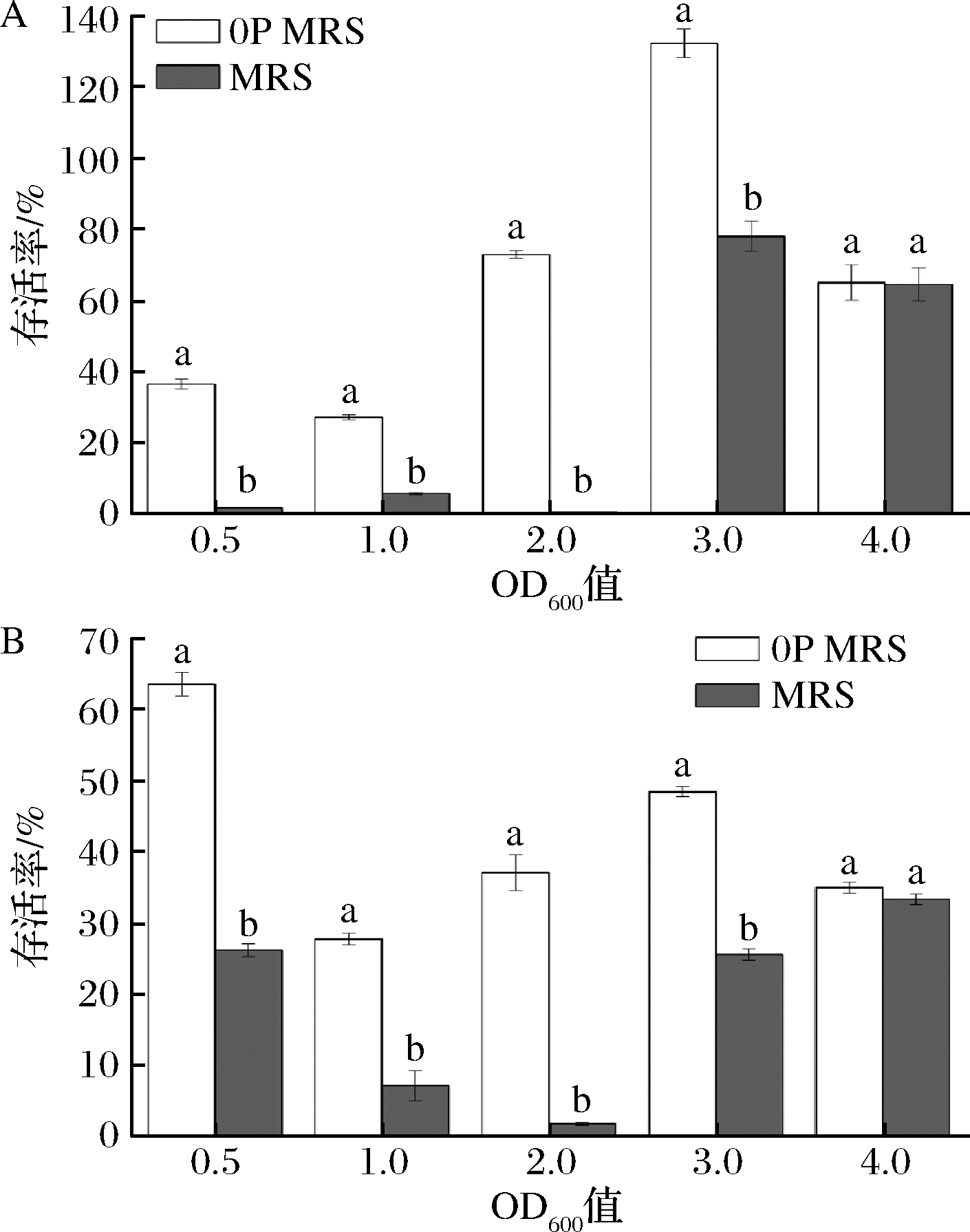
A-热胁迫(54 ℃,1 h);B-氧化胁迫(1.6 mmol/L H2O2,1 h)
图3 氮源对不同生长时期鼠李糖乳杆菌 hsryfm 1301 热胁迫和氧化胁迫耐受能力的影响
Fig.3 Thermotolerance and aerotolerance of L.rhamnosus hsryfm 1301 during different growth stages in MRS and 0P MRS
同样鼠李糖乳杆菌hsryfm 1301在不同的氮源浓度下各生长阶段的氧化胁迫存活率所呈现出的规律和热胁迫相似。在OD600值为0.5、1.0、2.0和3.0时,正常MRS培养后菌株的存活率显著低于0P MRS。其中当OD600值为2.0时这种现象最为明显,在这个生长时期低氮源培养(0P MRS)的存活率比正常MRS组提高了40倍(图3-B);而在OD600值为4.0时,低氮源组和正常组无显著差异。这说明高浓度胰蛋白胨培养不利于菌株抗氧化。
因此,在工业生产中较为重要的指数期和稳定前期,低氮源浓度环境下的鼠李糖乳杆菌hsryfm 1301有更强的耐热和耐氧化能力;而且菌株在低氮源环境中生长至OD600值为2.0时,其耐热能力和耐氧化能力最佳。
2.4 鼠李糖乳杆菌hsryfm 1301在低氮源培养下的常见胁迫耐受能力
在指数期,低氮源浓度环境对鼠李糖乳杆菌hsryfm 1301的耐热和耐氧化强化效果最佳。但是已有文献表明,氮源对乳酸菌的胁迫耐受往往发挥积极作用。在高渗环境下,嗜酸乳杆菌会在胞内累积脯氨酸[11];半胱氨酸作为氧化还原酶的核心位点,有助于发酵乳杆菌和嗜酸乳杆菌抵御氧化胁迫[12-13]。此外,唾液乳杆菌会利用蛋白水解系统产生更多的氨基酸来耐受胆盐胁迫[14]。
因此,低氮源培养对鼠李糖乳杆菌hsryfm 1301其他胁迫耐受能力的影响不可忽视。酸胁迫和胆盐胁迫是益生菌研究中最为重要的胁迫种类,低氮源培养和正常培养的鼠李糖乳杆菌hsryfm 1301的酸胁迫存活率分别为8.9%和9.7%,差异不显著,胆盐胁迫存活率也未受到明显影响,表明低氮源培养获得的鼠李糖乳杆菌hsryfm 1301菌体不会在胃肠道环境耐受中处于劣势。此外,冷冻胁迫和渗透压胁迫也是乳酸菌产品加工及贮藏过程中常见的胁迫,低氮源培养及正常MRS培养获得的鼠李糖乳杆菌hsryfm 1301菌体对-20 ℃的冷冻胁迫和8% NaCl的渗透压胁迫的耐受能力也没有差异(表2)。表明低氮源培养菌体在氧化胁迫和热胁迫耐受能力获得强化的同时,常见胁迫的耐受能力未受影响。
表2 氮源对鼠李糖乳杆菌 hsryfm 1301常见胁迫耐受能力的影响
Table 2 Tolerance of L.rhamnosus hsryfm 1301 to common stresses in MRS and 0P MRS
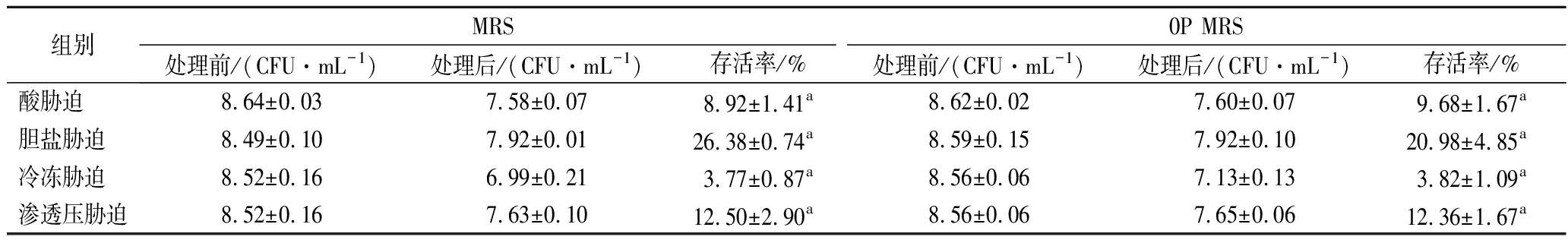
注:同行相同小写字母表示数据不存在显著性差异(P>0.05)
3 结论
减少培养基中蛋白胨的含量,鼠李糖乳杆菌hsryfm 1301在稳定前期以前的生长速度未受到显著影响,交叉适应和低氮源配合进一步提高了菌株的热胁迫和氧化胁迫耐受能力。指数期菌体在热胁迫和氧化胁迫下的存活率大幅上升,而且酸胁迫、胆盐胁迫、冷冻胁迫和渗透压胁迫的耐受能力未受影响。低氮源培养和交叉适应配合将有利于提高菌株在喷雾干燥等造成热胁迫和氧化胁迫的生产过程中的存活率。
- 我用了一个很复杂的图,帮你们解释下“23版最新北大核心目录有效期问题”。
- 重磅!CSSCI来源期刊(2023-2024版)最新期刊目录看点分析!全网首发!
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?
- 《农业经济》论文投稿解析,难度指数四颗星,附好发选题!
- 期刊知识:学位论文完成后是否可以拆分成期刊论文发表?
- 号外!出书的人注意啦:近期专著书号有空缺!!

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



