微波辅助低共熔溶剂提取、部分纯化螺旋藻多糖及其体外生物学活性研究
螺旋藻(Spriulina platensis)营养价值较高,是商业上必不可少的微藻之一,可直接用作食物或食物成分,亦可用作生物肥料、废水处理和生物柴油生产,以及化妆品和制药行业[1-2],其含有大量的蛋白质、必需脂肪酸(亚油酸和γ-亚麻酸)、多糖、氨基酸、维生素,尤其是复合维生素B和色素等[3]。螺旋藻中分离的多糖具有广泛的生物活性,如抗菌、抗氧化、抗癌、抗病毒和免疫应答等[4]。目前,可以借助热水、稀碱和不同的有机溶剂提取和分离多糖[5-6],然而,这些传统的提取方法通常复杂、耗时、低效且对环境有害。
低共熔溶剂(deep eutectic solvent,DES)作为新一代环境友好的“绿色”溶剂,具有替代有机溶剂的潜力,已引起广泛关注[7]。一般来说,DES是由氢键受体和氢键供体混合而成的[8]。氯化胆碱价格低廉、可生物降解且无毒,是最常用的氢键受体,而氢键供体可以是糖、醇或羧酸。DES已被证明是一种新型绿色溶剂,具有无毒、可生物降解和不可燃等优异的性能[9-10]。目前,DES正被用于有机合成和(生物)催化、生物化学、分析化学、纳米材料和提取过程[11-15]。高效、无污染的DES辅助微波提取法已广泛用于从天然植物材料中提取生物活性化合物,如类黄酮、异黄酮、酚类化合物和天然色素等[16-19]。然而,关于利用DES从螺旋藻中提取多糖的研究鲜有报道。
本研究评价了不同组合的DES对螺旋藻多糖提取效果的影响。在确定最佳的DES溶剂基础上,利用响应面优化法对与多糖得率相关的主要提取条件参数进行了优化,并通过大孔树脂对其部分纯化,对其抗氧化和抗癌活性进行评价。
1 材料和方法
1.1 材料、试剂和设备
螺旋藻粉末由甘肃省微藻技术创新中心提供;氯化胆碱、DL-苹果酸、柠檬酸、甘油、乙二醇、1, 4-丁二醇、尿素、L-脯氨酸、丙二醇、甲醇、乙醇、二甲基亚砜(dimethyl sulfoxide,DMSO)、胎牛血清(fetal bovine serum,FBS)、青霉素、链霉素、MTT,北京索莱宝科技有限公司;大孔树脂D3520,天津允开树脂科技有限公司;DPPH(纯度>99.5%)、ABTS(纯度>98.0%),上海源叶生物科技有限公司;丁基化羟基甲苯(butylated hydroxytoluene,BHT,纯度>98%)、维生素C (纯度>98%),成都德斯特生物科技有限公司;人宫颈癌细胞的HeLa细胞,武汉普诺赛生命科技有限公司。所有其他试剂和化学品均为分析纯。
U-T6 紫外可见分光光度计,屹谱仪器制造(上海)有限公司;DF-101S5L数显恒温水油浴锅,上海力辰邦西仪器科技有限公司;MCR-3微波化学反应器,巩义市科瑞仪器有限公司。
1.2 DES合成
DES的合成是将氢键受体氯化胆碱和1种或者2种氢键供体按照一定物质的量比混合,80 ℃磁力搅拌3~4 h,直至形成清澈均匀的液体,制备得到DES。结果如表1所示。
表1 不同类型DES的制备
Table 1 Preparation DES systems in the experiment

1.3 微波辅助低共熔溶剂提取多糖
为了选择最佳提取溶剂,在微波反应管中称取1 000 mg螺旋藻粉末加入10 mL DES水溶液(去离子水含量:30%,质量分数),采用微波反应系统在80 ℃下处理30 min,混合物以8 000×g离心15 min。在定量分析之前,用相应提取溶剂将上清液固定到20 mL。实验重复3次。采用苯酚-硫酸法测定多糖含量,其得率由以下公式(1)计算:
多糖得率![]()
(1)
式中:C,提取液中的多糖质量浓度,mg/mL;V,稀释提取物的体积,mL;m,提取样品的质量,g
1.4 微波辅助DESs提取多糖的优化
在微波辅助DES提取多糖的过程中,DES含水量、提取时间、提取温度和固(样粉)-液(提取剂)比是4个主要因素。通过改变水含量(0%、10%、20%、30%、40%、50%,质量分数)、提取时间(10、20、30、40、50、60 min)、提取温度(50、60、70、80、90、100 ℃)和固液比(10、20、30、60、80、100 mg/mL),研究微波辅助DES提取螺旋藻多糖条件。基于以上实验结果,采用响应面法优化其提取工艺。应用BBD获得该提取中4个主要自变量的最佳值:DES含水量(A)、提取时间(B)、提取温度(C)和固液比(D)在3个不同水平(-1、0、1)。以多糖得率作为设计实验的响应值。基于实验数据进行回归分析。随后,在最佳条件下进行了3次验证提取实验,以验证统计实验策略的准确性。
1.5 从DES提取物中回收和部分纯化多糖
在最佳条件下提取后,将DES提取多糖装载到大孔树脂D3520-Cl(3.5 cm×30 cm)上。用100 mL去离子水洗涤以除去DES后,用100 mL 0.1 mol/L(洗脱液1)、0.3 mol/L(洗脱液2)和0.5 mol/L(洗脱液3)的NaCl溶液以3 mL/min的流速梯度洗脱该柱;然后,分别收集洗脱液并采用苯酚-硫酸法测定洗脱液中多糖含量,选择目标组分用于进一步的体外活性检测。
1.6 多糖的抗氧化活性
1.6.1 DPPH自由基清除活性
将提取和部分分离的多糖溶解在蒸馏水中以获得不同质量浓度(0.1、0.5、1、2、3、4和5 mg/mL)的样品溶液。然后,将0.1 mL多糖溶液与0.4 mL DPPH乙醇溶液(0.1 mol/L)混合后在室温遮光条件静置,反应30 min后,在517 nm处测定吸光度。用DES提取的多糖清除DPPH自由基活性与已知的抗氧化剂(如BHT和维生素C)进行了比较。DPPH自由基清除活性按照公式(2)计算:
DPPH自由基清除活性![]()
(2)
式中:A空白,空白对照(含有除多糖之外的所有试剂)的吸光度;A样品,样品的吸光度。
1.6.2 ABTS阳离子自由基清除活性
将97.15 mg ABTS和16.13 mg过硫酸钾与蒸馏水混合制备ABTS阳离子自由基储备溶液(25 mL)。室温下黑暗中孵育12 h,然后用无水乙醇稀释至734 nm处的吸光度为(0.70±0.02)。将0.1 mL不同质量浓度(0.1、0.5、1、2、3、4、5 mg/mL)的样品加入到0.9 mL ABTS溶液中,并在黑暗中孵育20 min。在734 nm处测量吸光度。维生素C和BHT作为阳性对照。ABTS阳离子清除活性按公式(3)计算:
ABTS阳离子清除活性![]()
(3)
式中:A空白,空白对照的吸光度(包含除多糖之外的所有试剂);A样品,样品的吸光度
1.7 多糖抗癌活性
1.7.1 细胞系和培养物
HeLa细胞在含有10%(体积分数)热灭活FBS和100 μg/mL青霉素-链霉素的RPMI-1640培养基中,在37 ℃和5% CO2的中培养。
1.7.2 生长抑制试验
为了评估DESs提取多糖对HeLa细胞生长的抑制作用,将细胞接种(5×104)在96孔板中,其中含有100 μL热灭活培养基,并在5% CO2培养箱中于37 ℃孵育24 h。然后,将含有来自DES提取物的0、50、100、200、300、400 μg/mL多糖的新鲜培养基加入到96孔板中,并在相同的条件下分别孵育24、48、72 h后,向每个孔中加入5 mg/mL MTT溶液(10 μL),细胞在37 ℃和5% CO2下孵育4 h。除去培养基后,向每个孔中加入150 μL DMSO。反应后,在490 nm处测量样品的吸光度。抑制率按公式(4)计算:
抑制率![]()
(4)
式中:A空白和A样品分别为对照和试验样品的吸光度
1.8 统计分析
数据用平均值±标准误差表示,差异之间显著性通过方差分析(ANOVA)进行检验,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 微波辅助DES提取多糖的工艺优化
2.1.1 不同类型DESs对多糖提取效果的影响
为了评估最佳DES提取溶剂,本研究评估了9种不同类型的DES对多糖提取效果的影响(图1)。

图1 不同种类低共熔溶剂对螺旋藻多糖提取效果的影响
Fig.1 Effects of different DESs on the yield of polysaccharide from Spirulina platensis
分别以不同醇、有机酸和尿素与氯化胆碱的固定混合物质的量比合成了3种醇基DES(DES-1、DES-2和DES-4)、3种有机酸基DES(DES-5、DES-6和DES-7)和1种脲基DES (DES-3)。DES-8和DES-9为3种组分的混合物。与常规溶剂相比,由于范德华力、氢键和不同组分间的静电相互作用,DESs具有较高的黏度。为提高提取效率,以质量比7∶3加水,用9种不同的DESs溶剂从螺旋藻中提取多糖,其中醇基DESs提取效果最好,其次是有机酸基 DESs和脲基DESs。与2种组分的混合物相比,DES-8和DES-9对多糖的提取能力不同,但均低于醇基DES。醇基DESs具有相对较小黏性和表面张力,1, 4-丁二醇内部空间足够大且醇基分支少, 且羟基的存在,增加了其与多糖的相互作用,其极性更适合多糖提取;此外,醇基DESs的提取效率高于水。基于上述结果,选择由氯化胆碱和1, 4-丁二醇(物质的量比为1∶4)组成的DES-4作为提取多糖的溶剂,并应用于后续试验。
2.1.2 DES含水量的影响
合成的DES具有一定的黏度,会影响萃取效率,具有一定含水量的DES体系有利于传质。由图2-a可知,在DES中加入不同含量的水提取螺旋藻多糖时,提取效果依赖于DES含水量。
当DES体系中的含水量从0%增加到30%时,螺旋藻多糖得率显著增加。然而,含水量的进一步增加(30%~50%)导致提取效果降低,这可能是因为DES系统中高浓度的水可能会限制多糖和DES组分之间的相互作用。因此,DES含水量选择30%用于进一步的实验。
2.1.3 提取时间、提取温度和固液比的影响
为了研究提取时间、提取温度和固液比对螺旋藻多糖提取率的影响,样品在这些因素变化的条件下依次提取,而保持其他提取条件不变。如图2所示,提取效率受提取时间、温度和固液比的影响。基于这些结果,Box-Behnken设计选择了以下最佳DES提取条件:提取时间30 min、提取温度80 ℃和固液比为20 mg/mL。
2.1.4 采用Box-Behnken设计优化提取条件
在单因素试验的基础上初步确定提取变量的范围后,使用Box-Behnken设计优化提取条件,响应面分析的因素和水平见表2。

a-DES含水量;b-提取时间;c-提取温度;d-固液比
图2 DES含水量、提取时间、提取温度和固液比对多糖提取效果的影响
Fig.2 Effects of different extraction parameters on the yield of polysaccharides.DES water content, extraction time, extraction temperature, and solid-liquid ratio
表2 响应面分析中的因素和水平
Table 2 Factors and levels in the response surface analysis

整个研究包括29个独立的实验,每个处理重复3次。与该实验相关的编码变量和响应如表3所示。
表3 BBD实验设计结果
Table 3 Results of the BBD for extraction optimization

预测模型的截距、线性、二次和交互作用项的回归系数见表4。模型P<0.000 1,表明该预测模型具有统计学意义,A、B、AC、BC、A2、B2、C2、D2参数具有统计学意义(P<0.05);说明实验因子与方程之间不是简单线性关系;DES水含量(A)和提取时间(B)是多糖提取工艺的主要决定参数。响应变量的决定系数(R2)为0.96,这意味着该回归模型可以预测结果。
表4 响应面方差分析结果
Table 4 The results the response surface analysis of variance

失拟项P值为0.098 1,差异不显著 (P>0.05),说明预测模型可准确地反映实验数据。
基于对所有实验数据的多元回归分析,使用二阶多项式方程来表示预测模型。回归模型方程如下:
Y=108.05-1.57A-1.77B+0.027C-0.26D+1.84AB-3.26AC-1.51AD-2.15BC+0.96BD+0.76CD-9.98A2-4.77B2-5.50C2-6.48D2
式中:Y,多糖得率;A,DES含水量;B,提取时间;C,提取温度;D,固液比。
通过对二阶多项式方程的分析,得出最佳提取条件为:DES含水量28.89%;提取时间27.74 min;提取温度80.78 ℃,固液比19.81 mg/mL,获得的多糖得率为108.34 mg/g。在实验过程中,考虑到实验实际操作条件,对以上数据进行修正:DES含水量29%、提取时间28 min、提取温度81 ℃、固液比20 mg/mL,在此条件下,获得的多糖平均得率为109.80 mg/g,说明此法可用于多糖的提取。
2.1.5 微波辅助DES提取与其他提取方法的比较
为了评价微波辅助DES提取法在提高提取效率方面的优势,将微波辅助DES提取法与包括热碱浸提[5]、超声波辅助提取[20]、回流提取[6]、三相萃取[21]和内部沸腾法[22]在内的其他螺旋藻多糖提取方法进行了比较,结果本法采用微波辅助提取具有最高的多糖得率。由于DES-4溶剂黏性和表面张力小, 1, 4-丁二醇内部空间足够大且醇基分支少, 氢键和多糖相互作用强,且极性更适合多糖提取;另外,微波的辐射作用穿透螺旋藻细胞,使得细胞壁破裂,有利于多糖的溶出。因此,本实验采用的微波辅助DES提取方法有效地提高了多糖的产量。
2.2 多糖的回收和部分纯化
根据最佳提取条件制备螺旋藻多糖,并按照1.5的方法对粗多糖提取物进行纯化。分别对3种洗脱组分(洗脱液1、洗脱液2和洗脱液3)进行收集、减压浓缩和透析、干燥处理。洗脱液1、洗脱液2和洗脱液3中多糖质量分别为(4.57±0.22)、(86.59±0.17)和(3.96±0.24) mg;多糖含量分别为(19.58±1.24)%、(88.96±0.47)%和(84.10±1.21)%。洗脱液2含有最高的多糖,其多糖含量相对高于洗脱液1和洗脱液3。因此,选择并大量产生洗脱液2,用于体外进一步的活性检测。
2.3 多糖的抗氧化活性
2.3.1 DPPH自由基清除活性
从螺旋藻中提取的多糖的抗氧化活性如图3所示。DPPH经常被用作检测化合物的自由基清除活性的代表性试剂。如图3-a所示,样品显示出浓度依赖性的DPPH自由基清除活性。与对照相比,活性水平依次增加顺序为:提取物、BHT和维生素C。当样品质量浓度从0.1 mg/mL增加到5 mg/mL时,提取物的DPPH自由基清除活性从19.58%增加到89.1%。提取多糖的IC50值(能够清除50% DPPH的提取物浓度)为0.97 mg/mL。基于这些结果,可以初步推断,在最佳条件下使用DES从螺旋藻中提取的多糖显示出优异的DPPH 自由基清除活性,因此其可以作为主要抗氧化剂。

a-DPPH自由基;b-ABTS阳离子自由基
图3 螺旋藻多糖DPPH自由基和ABTS阳离子 自由基清除活性
Fig.3 DPPH radical and ABTS cation radical-scavenging activities of the polysaccharides extracted from S. platensis
2.3.2 ABTS阳离子自由基清除活性
与DPPH自由基清除活性类似,样品的ABTS阳离子自由基清除活性在较高浓度下逐渐增强,与对照组相比,清除活性依次增加顺序为:提取物、BHT和维生素C(图3-b)。以上结果证实了用DES体系提取的螺旋藻多糖具有显著的体外ABTS阳离子自由基清除活性,IC50值为0.91 mg/ mL。DES被认为适合用于从螺旋藻中微波辅助提取多糖的溶剂体系,因此,所获得的纯化多糖显示出优异的体外抗氧化活性。
2.4 多糖的抗癌活性
从螺旋藻中提取的多糖在抗癌活性中起着重要作用。然而,用DES提取的螺旋藻多糖的抗癌活性的研究报道很少。因此,在本研究中评估了所获得的螺旋藻多糖的抗癌活性。由图4可知,用多糖处理后,测定24、48和72 h的HeLa细胞抑制率。结果表明,当质量浓度从50 μg/mL增加到200 μg/mL时,多糖提取物对HeLa细胞的抑制作用显著增强。在200 μg/mL质量浓度下72 h对HeLa细胞的最高抑制率为48.59%。随着样品质量浓度从200 μg/mL增加到400 μg/mL,多糖对HeLa细胞的抑制率反而降低。这可能是因为HeLa癌细胞在高浓度下可能产生了某种耐药性。因此,采用DESs从螺旋藻提取的多糖在一定浓度范围内可抑制了HeLa癌细胞的体外自我增殖。
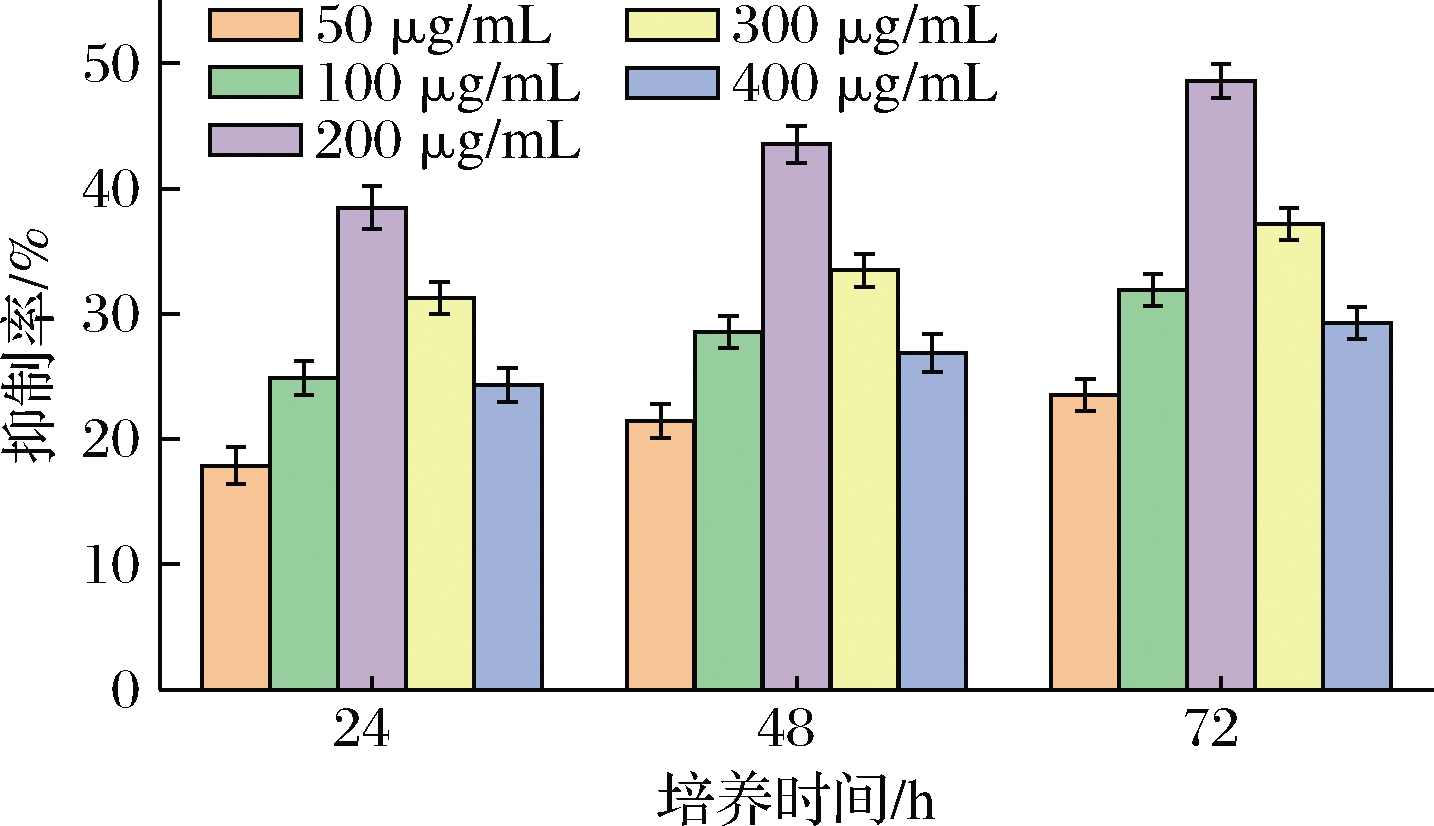
图4 不同浓度多糖样品对HeLa细胞的抑制率的影响
Fig.4 Inhibition rate of HeLa cells by polysaccharide samples of different concentrations
3 结论
基于DES的高效、简单和环保的微波辅助提取方法被应用于螺旋藻中多糖的提取。最佳提取溶剂为氯化胆碱和1,4-丁二醇(物质的量比为1∶4)组成的DES-4,提取效率优于其他溶剂。响应面法优化提取条件有效提高了提取效率,最终优化条件为:DES含水量29%、提取时间28 min、提取温度81 ℃、固液比20 mg/mL,在此条件下,获得的多糖平均得率为109.80 mg/g。经大孔树脂纯化后多糖具有良好的抗氧化活性和较强抑制HeLa细胞生长的作用。因此,DES作为一种绿色溶剂,可广泛用于天然植物材料中有效生物活性物质的提取。
- 我用了一个很复杂的图,帮你们解释下“23版最新北大核心目录有效期问题”。
- 重磅!CSSCI来源期刊(2023-2024版)最新期刊目录看点分析!全网首发!
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?
- 《农业经济》论文投稿解析,难度指数四颗星,附好发选题!
- 期刊知识:学位论文完成后是否可以拆分成期刊论文发表?
- 号外!出书的人注意啦:近期专著书号有空缺!!

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



