超微粉碎对枣粉理化性质、功能特性及结构特征的影响
枣(Ziziphus jujuba Mill.),鼠李科枣属植物,又称为枣子、大枣,原产于我国,在山西、山东、河南、河北、新疆、陕西等地大量种植。枣具有较高的营养价值,含有糖类、有机酸、蛋白质及大量对人体有益的矿物质,还是维生素、三萜类、多酚类、核苷酸类和生物碱等生物活性物质的良好来源,具有抗氧化、降血糖、调节心血管和保肝等作用[1]。鲜枣营养丰富,甜而多汁,但不耐贮藏易腐烂,货架期较短。因此,除鲜食以外,75%以上的鲜枣被加工成干枣,以延长枣果的货架期,充分利用枣的营养价值。
超微粉碎是一种新型的粉碎技术,可生产具有良好表面性能,粒径分布窄而均匀的粉体。在食品工业中,超微粉碎有利于营养物质的溶出,加工后的粉体分散性较好,能更好地被人体吸收,已广泛应用于姜[2]、枸杞[3]、葡萄[4]等果蔬粉的制备中。HU等[5]研究发现超微粉碎可增加绿茶多糖的含量,并增强其抗氧化活性,同时也减少了苦味。张丽媛等[6]将苹果膳食纤维进行超微粉碎后发现其水溶性、溶胀性、阳离子交换能力及抗氧化性等理化性质都得到显著改善。目前,枣的干制品大多都是整颗干枣,对枣粉的研究较少。因此,本研究将新鲜的冬枣采用真空冷冻干燥法制备冻干枣,随后通过普通粉碎和超微粉碎2种粉碎方式制作枣粉,探讨超微粉碎对枣粉的理化性质、功能特性及结构的影响,以期为枣粉加工提供理论参考。
1 材料与方法
1.1 材料与试剂
山东沾化冬枣,购自农贸市场,挑选大小均匀,成熟度一致,无明显病斑果实清洗干净并去核,置于-40 ℃ 冰箱待用。
丙酮、HCl、NaOH、NaCl、乙酸乙酯、正己烷、三氯化铁,均为分析纯,成都科龙化工试剂;福林酚试剂、Trolox、DPPH、ABTS,均为分析纯,美国Sigma公司。
1.2 仪器与设备
SCIENTZ-20F真空冷冻干燥机、XHF-D高速分散器,宁波新芝公司;UltraScan Pro测色仪,美国Hunter Lab公司;Phenom Pro扫描电子显微镜,荷兰Phenom World公司;X′Pert PRO X射线衍射仪,荷兰帕纳科公司;TG209F1热重分析仪,德国耐驰公司;Spectrun100傅里叶红外光谱仪,美国Perkin Elmer公司;PAL-1数显手持折射仪,日本ATAGO公司;SynegyH1MG酶标仪,美国基因公司;V-1000可见分光光度计,翱艺仪器(上海)公司;RV 10旋转蒸发仪,德国IKA公司;1-15PK离心机,美国Sigma公司;LC-20AT高效液相色谱仪,日本岛津公司;Mastersizer 3000激光粒度仪,马尔文帕纳科公司;高速万能粉碎机,兆申电器公司;CJM-SY-B高能纳米冲击磨,秦皇岛太极环纳米制品有限公司。
1.3 实验方法
1.3.1 枣粉制作工艺
将冬枣去核后切成12瓣,在-40 ℃预冷24 h后采用真空冷冻干燥法干燥。干燥程序为:-40 ℃,3 h;-30 ℃,2 h;-20 ℃,2 h;-10 ℃,6 h;0 ℃,5 h;10 ℃,6 h;20 ℃,5 h;30 ℃,7 h(真空度<10 Pa,冷阱温度-60 ℃)。随后,冻干枣在高速万能粉碎机中粉碎10 s,重复3次,每次间隔3 min,过60筛后得到普通粉碎枣粉(普通粉)。将普通粉投入高能纳米冲击磨中,粉碎6 h(转速380 r/min,粉碎腔温度≤20 ℃),制得超微粉碎枣粉(超微粉)。
1.3.2 理化性质测定
1.3.2.1 粒径测定
利用激光粒度仪测定粉体的粒径及其分布,即粒度分布的跨度(Span)和细胞壁破损率(Φ)[3]。其中D10、D50、D90是指累计粒度分布百分数分别达到10%、50%、90%时所对应的粒径,D50常用于表示粉体的平均粒度。当D50<10 μm时,Φ=1[7]。宽度和Φ的计算如公式(1)和公式(2)所示:
(1)
(2)
1.3.2.2 休止角及滑动角测定
参照HUANG等[8]的方法。
1.3.2.3 容积密度测定
参考赵萌萌等[9]方法略作修改,取10 mL量筒(质量为m1),将适量样品填充在量筒中至体积为2 mL,称量量筒加样品的质量(m2),容积密度按公式(3)计算:
容积密度![]()
(3)
1.3.2.4 色度测定
采用色差仪测定枣粉的亮度值CIELab(L*、a*、b*),色差(ΔE)色相角(H)、色度(C),计算如公式(4)~公式(6)所示:
(4)
(5)
(6)
1.3.2.5 溶胀性测定
准确称取1.000 0 g(质量为m)样品放入试管中,记录体积(V1),加入10 mL纯水,振荡混匀室温静置24 h,记录体积(V2)[10]。溶胀性按公式(7)计算:
溶胀性![]()
(7)
1.3.2.6 持水力测定
准确称量1.000 0 g枣粉(m1)于离心管(m2)中,加入50 mL纯水,磁力搅拌30 min,高速离心后去除上清液,称取样品加离心管的最终质量(m2),持水力计算如公式(8)所示:
持水力![]()
(8)
1.3.2.7 持油力测定
准确称量0.500 0 g枣粉(m1)于离心管(m2)中,加入10 mL植物油,室温下静置1 h,高速离心后去除上清液,称取样品加离心管的最终质量(m3),持油力计算如公式(9)所示:
持油力![]()
(9)
1.3.2.8 水溶性测定
准确称量样品1.000 0 g(m1),加入50 mL纯水混匀,于80 ℃水浴30 min,取出冷却后高速离心,将其上清液在105 ℃条件下烘干至恒重(m2)[11],水溶性计算如公式(10)所示:
水溶性![]()
(10)
1.3.2.9 可溶性固形物含量(total soluble solid,TSS)测定
采用手持折射仪测定枣粉的TSS。
1.3.2.10 复水性测定
参考周禹含等[12]方法略作修改,将1.000 0 g枣粉(m1)与20 mL纯水混合,室温下静置1 h,高速离心(10 000×g, 30 min),取沉淀物称取质量(m2),复水性计算如公式(11)所示:
复水性![]()
(11)
1.3.2.11 吸湿性测定
参考周禹含等[12]方法略作修改,准确称量1.000 0 g枣粉(m1)于内径35 mm的培养皿中,将其置于含有饱和氯化钠溶液的干燥器上部,将干燥器置于25 ℃培养箱中,每隔24 h称量枣粉质量(m2),连续2次的质量差<1 mg即为吸湿平衡。在干燥器中放置约0.2 g麝香草酚以抑制霉菌的生长。吸湿率如公式(12)所示:
吸湿率![]()
(12)
1.3.3 营养成分及功能特性测定
1.3.3.1 基本营养成分测定
采用GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》测定还原糖的含量;采用GB 5009.86—2016《食品安全国家标准 食品中抗坏血酸的测定》测定维生素C的含量;采用GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》测定脂肪含量;采用GB 5009.4—2016《食品安全国家标准食品中灰分的测定》测定灰分含量;采用蒽酮硫酸法测定总糖的含量[13];采用酶-重量法测定膳食纤维的含量[14]。
1.3.3.2 多酚提取及含量测定
(1)枣粉多酚提取
游离酚及结合酚的提取参考OKARTER等[15]方法。
(2)枣粉多酚含量测定
标准曲线制备:参考CHU等[16]的方法。以没食子酸浓度为横坐标,吸光值为纵坐标制作标准曲线,得回归方程:y=0.003 9x+0.032 9(R2=0.997 6)。
枣粉多酚含量测定:以适宜浓度的多酚提取液替代标准曲线制备过程的标准溶液,结果以每克枣粉中所含没食子酸当量(mg GAE/100g DW)表示。
1.3.3.3 抗氧化活性测定
枣粉提取液的制备参考刘冬[17]的方法。
总还原力测定[17]采用FRAP法。以Trolox为阳性对照,得回归方程:y=0.743 4x+0.081 2(R2=0.998 4)。
DPPH自由基清除率测定参考郭小宁等[18]的方法。以Trolox为阳性对照,得回归方程:y=0.352 1x-0.996 6(R2=0.998 2),DPPH自由基清除率计算如公式(13)所示:
DPPH自由基清除率![]()
(13)
式中:Ai为实验组的吸光值,Aj空白组的吸光值。
ABTS阳离子自由基清除率测定参考郭小宁等[18]的方法。以Trolox为阳性对照,得回归方程:y=68.932 0x+27.621 4(R2=0.998 6),ABTS阳离子自由基清除率计算如公式(14)所示:
ABTS阳离子自由基清除率![]()
(14)
式中:A样品和A空白分别表示样品和空白的吸光度,抗氧化能力以Trolox当量(TEAC)μmol TE/g计。
1.3.4 结构特征测定
1.3.4.1 扫描电镜分析
使用导电胶将适量样品粘于载物片上,随后将样品进行喷金处理,在10 kV加速电压条件下观察样品形态特征。
1.3.4.2 傅里叶红外光谱扫描
取适量样品与干燥后的KBr(1∶100,质量比)于玛瑙研钵中,充分研磨后加入压膜器内压片。以空气为扫描背景,扫描范围400~4 000 cm-1,扫描分辨率4 cm-1,扫描32次[11]。
1.3.4.3 X-射线衍射
使用载玻片将枣粉轻轻压在铝盘上,并在10°~80°的衍射角(2θ)扫描,扫描速率为2°/min[19]。
1.3.4.4 热重(thermogravimetry,TG)分析
取1~5 mg样品,在氮气流下从30~800 ℃进行热重分析,升温速率为10 ℃/min[20]。
1.4 数据分析
每组实验平行测定3次,实验结果采用SPSS Statistics 18.0数据分析软件进行相关统计分析,并用Origin 2018作图。
2 结果与分析
2.1 超微粉碎对枣粉理化性质的影响
2.1.1 粒径
粒径大小可直接衡量超微粉碎的效果,由表1和图1可知,枣粉经超微粉碎后,粒径降至20 μm以下,比表面积显著增大(P<0.05),已达到超微粉碎的效果(<30 μm)。相较于普通粉,超微粉的跨度值从2.88降至2.58(P<0.05),表明超微粉分布更加均匀。超微粉的粒径分布范围较窄,粉体的均一性较好,但是存在大粒径分布,可能是因为枣粉经超微粉碎后粒径变小,使得其表面活性增大,进而引发团聚,出现大颗粒[21]。
表1 超微粉碎前后枣粉的颗粒粒径和比表面积
Table 1 Particle size and specific surface area of jujube powder before and after superfine grinding

注:Sw为比表面积;不同小写字母表示差异显著(P<0.05)(下同)
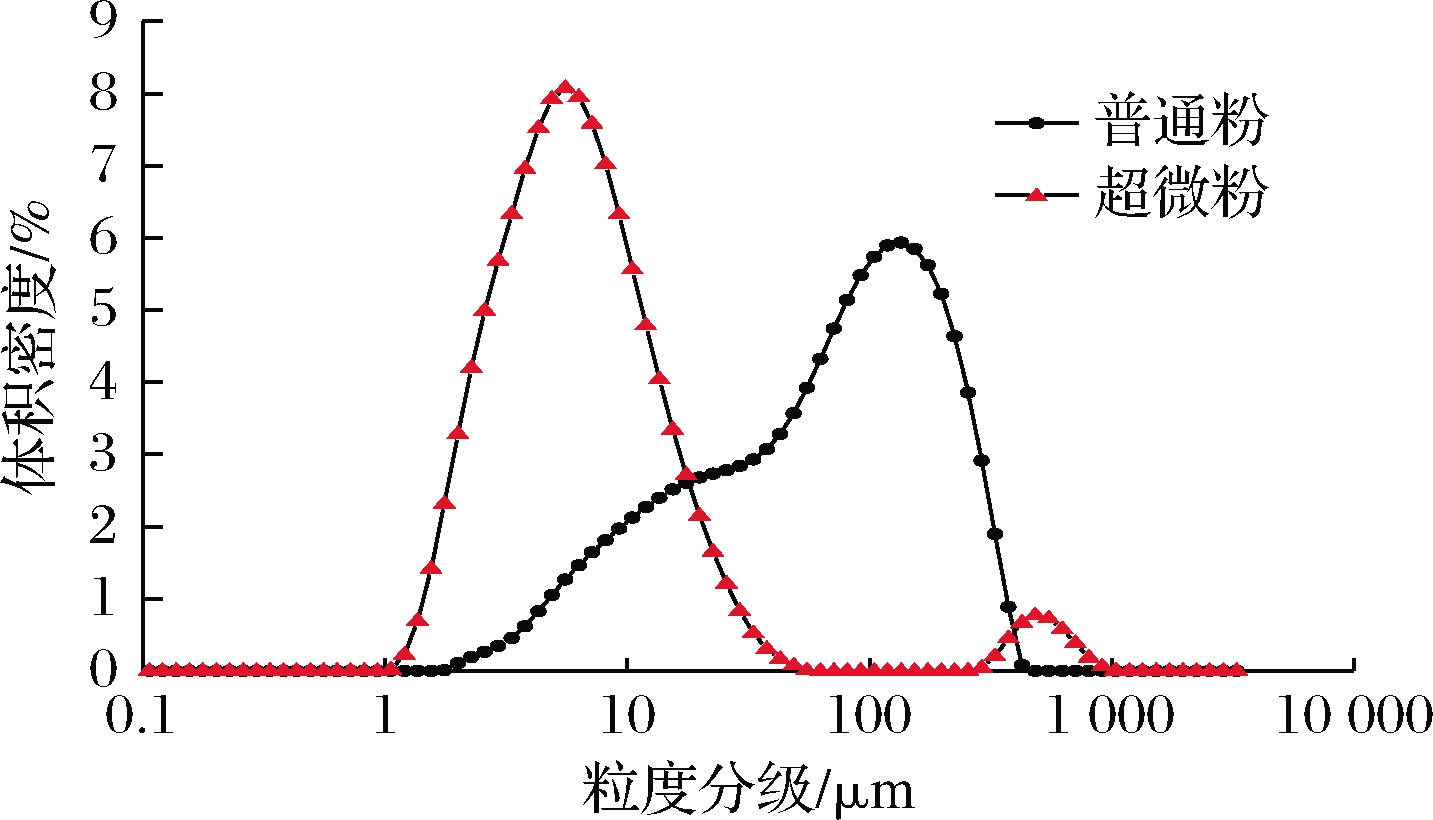
图1 超微粉碎前后枣粉粒径分布
Fig.1 Particle size distribution of jujube powder before and after superfine grinding
2.1.2 色泽
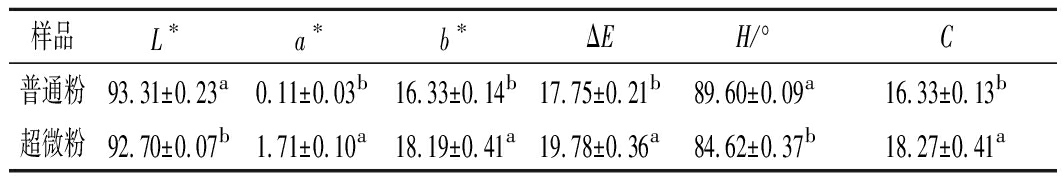
色泽是食品重要的感官品质指标之一,可影响消费者对食品的接受度。由肉眼观察可知,普通粉呈鲜绿色,接近冬枣果肉颜色,而超微粉碎枣粉色泽偏黄。从表2可以看到,超微粉的亮度(L*)及色相角(H*)显著降低,红色度(a*)、黄色度(b*)及色差(ΔE)显著增加(P<0.05);色度(C)显著增加,饱和度更大,表明超微粉的颜色更鲜艳。
2.1.3 休止角与滑动角
滑动角和休止角可反映粉体的流动性,通常其值越小的粉体流动性越好。如表3所示,与普通粉相比,超微粉的休止角和滑动角均显著减小(P<0.05),表明超微粉的流动性较好,可能是因为枣粉经超微粉碎后,颗粒成球状,相较于普通粉更圆滑,使得在滑动过程中摩擦力较小,从而导致超微粉的流动性较好。同时,2种枣粉的休止角均<40°,说明本研究制备的枣粉可适应生产需求,超微粉碎亦可提高枣粉的加工性能。
2.1.4 容积密度
容积密度反应了粉体的充填性能,其值越大,粉体充填性越好。普通粉和超微粉的容积密度分别是0.34、0.91 mL/g,与普通粉相比,超微粉的容积密度显著增加,分析原因是超微粉粒经较小,粉体更加均匀,且颗粒间隙较小,增大了粉体的接触面积,从而使得粉体的容积密度增大,这与ZHAO等[22]研究结果一致。因此,超微粉更有利于制作成片剂、胶囊等,丰富枣粉的产品种类,提升其应用价值。
表2 超微粉碎前后枣粉色泽的变化
Table 2 Color of jujube powder before and after superfine grinding
2.1.5 持水力、持油力
持水力、持油力是样品受到外部离心力或压力时保持水分、油的能力。如表3所示,与普通粉相比,超微粉的持水力显著降低(P<0.05),从101.22%下降至47.00%,可能是因为枣粉在超微粉碎过程中破坏了枣粉的细胞结构,使其对水分的束缚力减小从而导致持水力下降,这与赵萌萌等[9]的研究结果相似。另外,枣粉经超微粉碎后水溶性膳食纤维(soluble dietary fiber, SDF)含量增加(表4)也可能是导致超微粉持水力降低的原因。然而,与普通粉相比,超微粉的持油力显著增加4.53%(P<0.05),可能是因为超微粉碎在破坏枣粉细胞结构时,大量的亲油基团暴露出来,增强了超微粉的持油力,这与王博等[21]的研究结果相似,他们将杂粮粉超微粉碎以后,持油力提高了61.2%。由此可以推测,相较于普通粉,超微粉在加工过程中可减少脂肪的流失,更有利于吸附肠道中的脂类使得血清中胆固醇的含量降低,进而达到降血脂的效果[10]。
表3 超微粉碎前后枣粉的理化特性
Table 3 The physicochemical properties of jujube powder before and after superfine grinding

表4 超微粉碎前后枣粉的基本营养成分
Table 4 Basic nutrients in jujube powder before and after superfine grinding

注:IDF为不溶性膳食纤维(insoluble dietary fiber)
2.1.6 水溶性及TSS含量
样品的水溶性以及TSS含量是重要的食用品质指标。如表3所示,普通粉和超微粉的水溶性分别为73.27%、78.82%,超微粉碎后枣粉的水溶性显著增大(P<0.05)。枣粉经超微粉碎后,其比表面积显著增大(表1),枣粉在水中的溶解性和分散性增加,且超微粉碎后细胞破碎程度增大可溶性物质更易溶出,从而提高了枣粉的水溶性指数[23]。同时,也观察到枣粉的TSS在超微粉碎后显著增加,这在周禹含等[24]的研究中有相似结果。因此,超微粉比普通粉更有利于开发水溶性产品。
2.1.7 溶胀性和复水性
溶胀性可反映粉体的水结合能力,其值越大,粉体溶于水后的稳定性、悬浮性越好。由表3可知,枣粉经超微粉碎后溶胀性上升了1.01 mL/g(P<0.05),说明超微粉溶于水后稳定性及悬浮性更好。枣粉经超微粉碎后,较多细胞被破碎(表1),可使大量的亲水基团暴露出来,增加了粉体与水的接触部位及面积;同时亦可增加短链膳食纤维,其在水中膨胀伸展产生更大的溶积,从而使得溶胀性增加[11]。然而,枣粉经超微粉碎后复水性降低了42.72%(P<0.05),枣粉的复水性可能与粒径呈正相关,粒径越大,复水性越大,这在超微蒜粉中有相似的结果[18]。另外,超微粉复水性降低可能是因为枣粉中含有大量的糖类物质(表5),在粒径减小的同时颗粒间的空隙也减小,导致枣粉在水中更易黏结,聚集成团后水分向内部渗透受到抑制。
表5 超微粉碎前后枣粉的生物活性成分
Table 5 Bioactive compounds in jujube powder before and after superfine grinding

2.1.8 吸湿性
枣粉中含有大量处于无定形形态糖和有机酸等物质,其玻璃化转变温度较低,极易吸湿结块,导致产品的生物稳定性变差,从而影响产品质量。如图2所示,在前3 d超微粉的吸湿率显著低于普通粉(P<0.05),随后2种粉的吸湿率无显著差异,且均在第9天达到吸湿平衡,普通粉和超微粉的平衡吸湿率分别为33.25%、33.44%。枣粉在第5天时吸湿接近平衡,将1~5 d的吸湿数据进行回归分析(表6),2种枣粉的吸湿过程皆是减速吸湿,超微粉的吸湿初速度和加速度均大于普通粉。然而,第4天时,普通粉的吸湿速度大于超微粉,可能是因为在初始阶段超微粉粒径较小,比表面积较大,与水分充分接触,吸湿较快,而随着吸湿程度的不断增加,枣粉凝结成块,抑制了水分的渗透速度,从而使得在第4天时超微粉的吸湿率大于普通粉,吸湿速度小于普通粉。总的来说,超微粉碎有利于枣粉的短期贮藏;对于长期贮藏,2种粉的吸湿性无显著性影响。
表6 超微粉碎前后枣粉吸湿数据回归分析
Table 6 The hygroscopic regression analysis of jujube powder before and after superfine grinding

注:y为吸湿率(%);x为时间(d)

图2 超微粉碎前后枣粉的吸湿曲线
Fig.2 The moisture absorption curve of jujube powder before and after superfine grinding
注:不同小写字母表示差异显著(P<0.05)(下同)
2.2 超微粉碎对枣粉营养成分及功能特性的影响
2.2.1 基本营养成分
如表4所示,普通粉及超微粉中灰分含量分别为2.38、2.41 g/100g,粗脂肪含量分别为3.03、3.25 g/100g,2种粉体差异不显著。普通粉及超微粉的蛋白质含量分别为11.46、12.21 g/100g,低于冷冻干燥的壶瓶枣[13],超微粉碎显著提高了枣粉中蛋白质的含量(P<0.05),可能是因为蛋白质紧密的组织结构经超微粉碎后被破坏,表面积增大,溶解性增加,从而导致检测到超微粉中的蛋白质含量显著高于普通粉。另外,超微粉碎可使枣粉中的膳食纤维重新发生分配,显著增加SDF的含量,降低IDF的含量,即SDF/IDF值从0.54上升至0.73,分析原因是半纤维素和纤维素降解成SDF造成[14],或者是IDF中糖苷键的断裂转化为可溶性物质,从而提高了SDF/IDF值,这在超微粉碎脐橙中有相似的结果[14]。
2.2.2 生物活性成分
由表5可知,普通粉和超微粉的维生素C含量分别为857.57、1 113.34 mg/100g,与周禹含等[12]测定的冬枣粉维生素C含量相当,是橙子(68.88 mg/100g)的数十倍[25]。与普通粉相比,超微粉的维生素C含量显著增加(P<0.05),总糖及还原糖含量分别增加了5.76、1.16 g/100g(P<0.05)。表明超微粉碎有利于枣粉维生素C及糖类物质的保留。枣粉中的酚类物质以游离酚为主,经超微粉碎后其游离酚、总酚含量分别增加8.38、8.27 mg GAE/g,结合酚含量减少0.13 mg GAE/g(P<0.05)。可能是因为枣粉中的结合酚与果胶、纤维素及蛋白质等以共价结合(酯键、醚键)的方式存在于细胞壁中,不易溶出,而超微粉碎可使纤维素、蛋白质的结构改变及细化,利于此类结合酚的释放,从而以游离酚的形式被提取检测到[26];同时超微粉碎可使枣粉细胞壁充分破碎,在提取检测过程中,促进酚类物质的溶出。
为了更好地解释超微粉碎有利于生物活性物质的溶出,本研究对枣粉的Φ值进行了分析,Φ值越大代表细胞壁破碎率越大。如表1所示,普通粉和超微粉的Φ值分别为35%、100%,超微粉碎显著提高了枣粉的细胞壁破碎率(P<0.05),表明超微粉碎更有利于打破枣粉的细胞壁,从而降低传质阻力,促进细胞内物质的释放。总的来说,超微粉碎能有效地促进枣粉中生物活性物质的释放,充分利用其营养价值,这在HE等[7]、ZHANG等[3]的研究中有相似的结果。
2.2.3 抗氧化活性
植物提取物中含有较多的具有抗氧化性的生物活性成分,其氧化过程较为复杂,通常评价植物提取物的抗氧化活性不能使用单一的评价方法。本研究采用DPPH自由基清除率、ABTS阳离子自由基清除率和FRAP还原力3种方法来评价枣粉的抗氧化性,Trolox当量越大表明抗氧化效果越好。如图3所示,3种评价方法中,超微粉表现出的抗氧化活性均显著大于普通粉(P<0.05)。由表7可知,枣粉提取物的抗氧化性与除结合酚外的生物活性物质含量都呈正相关。其中3种评价方法都表明与维生素C含量呈显著正相关性(ABTS阳离子自由基清除力极显著),与结合酚含量呈显著负相关。此结果与超微粉碎前后生物活性物质含量变化结果保持一致(表5),表明超微粉碎有利于增强枣粉的抗氧化性。超微粉碎减小了枣粉的粒径,增加了表面积,且充分地破坏了枣粉的细胞壁,促进了多酚、多糖、维生素C等活性物质的释放,从而提高了枣粉的抗氧化性,这与ZHAO等[4]的研究结果相似。
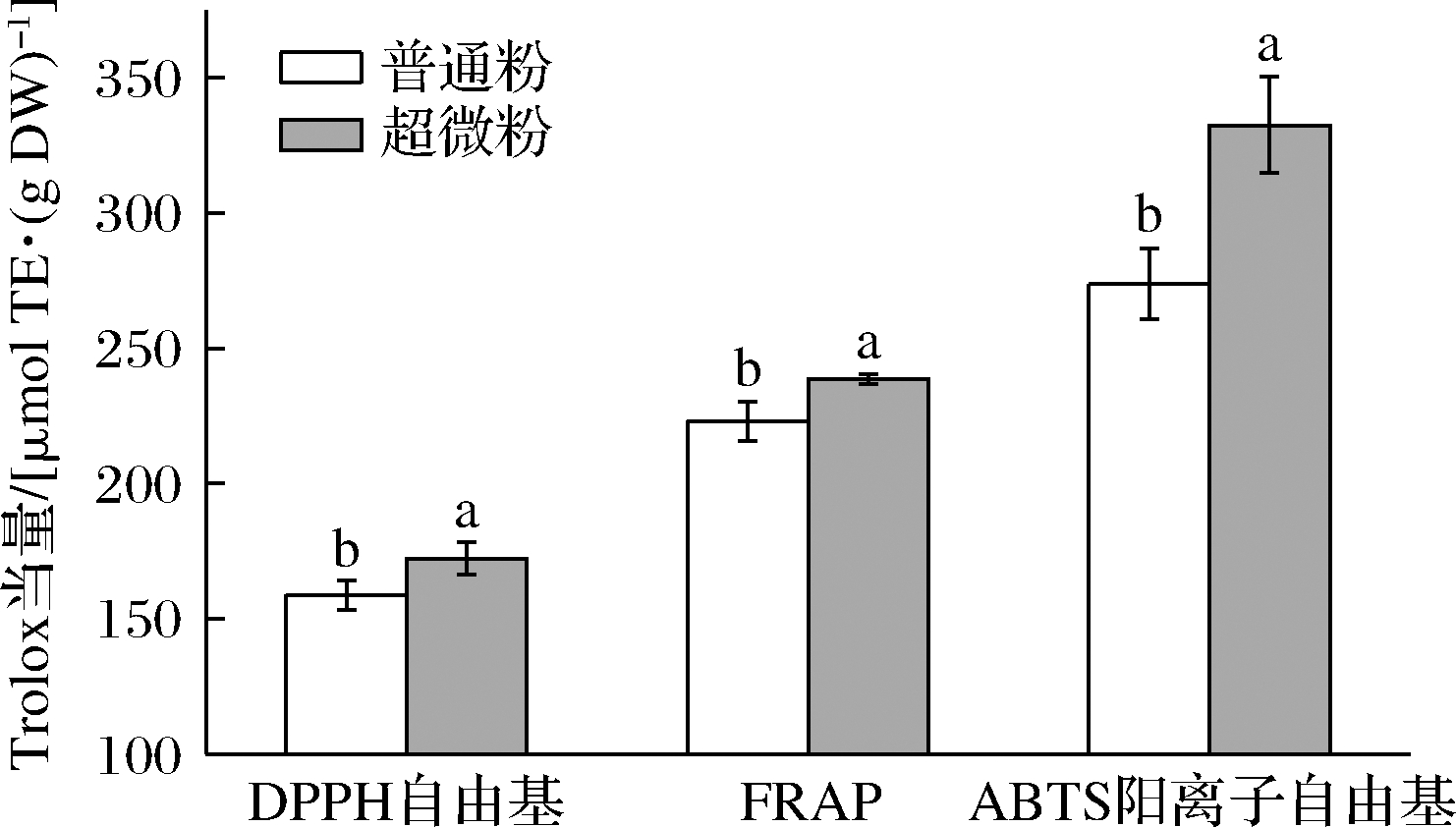
图3 超微粉碎前后枣粉的抗氧化活性
Fig.3 Antioxidant activity of jujube powder before and after superfine grinding
表7 超微粉碎前后枣粉抗氧化性与生物活性成分的 相关性分析
Table 7 Correlation analysis between antioxidant activity and bioactive substances of jujube powder before and after superfine grinding
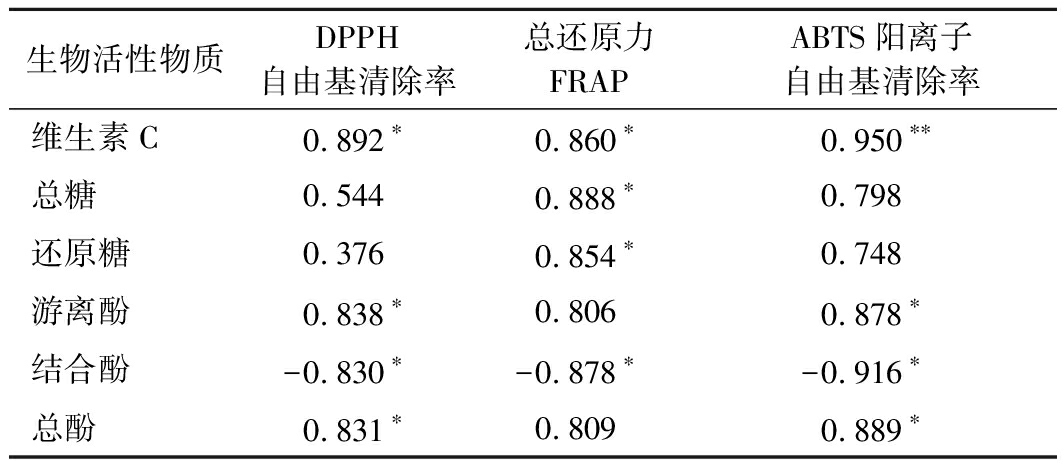
注:表中数值为正值,表示具有正相关;表中数值为负值,表示具有负相关;*和**分别表示在P<0.05水平相关性显著和P<0.01水平相关性极显著
2.3 超微粉碎对枣粉结构特征的影响
2.3.1 扫描电镜分析
由图4可知,普通粉和超微粉都具有较完整的组织结构,其中普通粉颗粒较大、不均匀,可观察到大多呈块状;超微粉的粒径减小,形态由块状变成圆形颗粒,但是其团聚现象较严重,粒径减小后其表面吸附增强,粉体之间的相互作用力增大,表现出分布密集、表观粒径增加的现象。另外,还可观察到超微粉的组织破坏程度也明显大于普通粉,这可以用来解释超微粉的细胞壁破碎率显著高于普通粉的原因。

a-普通粉(×300);b-普通粉(×1 000);c-超微粉(×300); d-超微粉(×1 000)
图4 超微粉碎前后枣粉的扫描电镜图
Fig.4 SEM images of jujube powder before and after superfine grinding
2.3.2 红外光谱分析
由图5可知,2种枣粉特征峰出峰位置基本一致,未产生新的化学基团,表明超微粉碎对枣粉红外光谱特征吸收影响不大,枣粉经超微粉碎后分子结构没有发生变化,这在超微粉碎玉米杆[22]、生姜粉[2]中都观察到相似的结果。在枣粉的主要吸收峰中,3 368 cm-1附近的吸收峰可能与枣粉中纤维素衍生的酚和醇有关;在2 932 cm-1附近的吸收峰源于—CH2 或—CH3上C—H的伸缩振动;1 622 cm-1处的吸收峰可归类为酰胺的N—H面内弯曲;1 414、1 385 cm-1 处的吸收峰是—CH2和—CH对称弯曲振动引起的;1 259 cm-1处的吸收峰是由C—O伸缩振动引起;950~1 200 cm-1被认为是碳水化合物的“指纹”区域,1 058、1 103 cm-1处的吸收峰可能是由糖环中的C—O—C、C—O—H振动引起;在619 cm-1附近的吸收峰可能是因为由制样过程中KBr与枣粉中某些物质发生取代反应生成卤化物所致[27]。
2.3.3 X-射线衍射分析
由图6可知,普通粉和超微粉的X衍射图谱呈现出明显的无定形特征,没有尖锐的结晶峰。枣粉中存在大量的葡萄糖、蔗糖、果糖等低分子质量糖以及有机酸,这些物质在干燥过程中快速脱水,来不及结晶就形成无定形的亚稳态干燥产品[19]。另外,不同粒径的枣粉衍射强度无明显差异,说明超微粉碎并未破坏枣粉的结晶区域,结果与FTIR的结果保持一致,表明超微粉碎不会改变枣粉的分子结构和晶体形式,这在HUANG等[8]中有相似的结果。
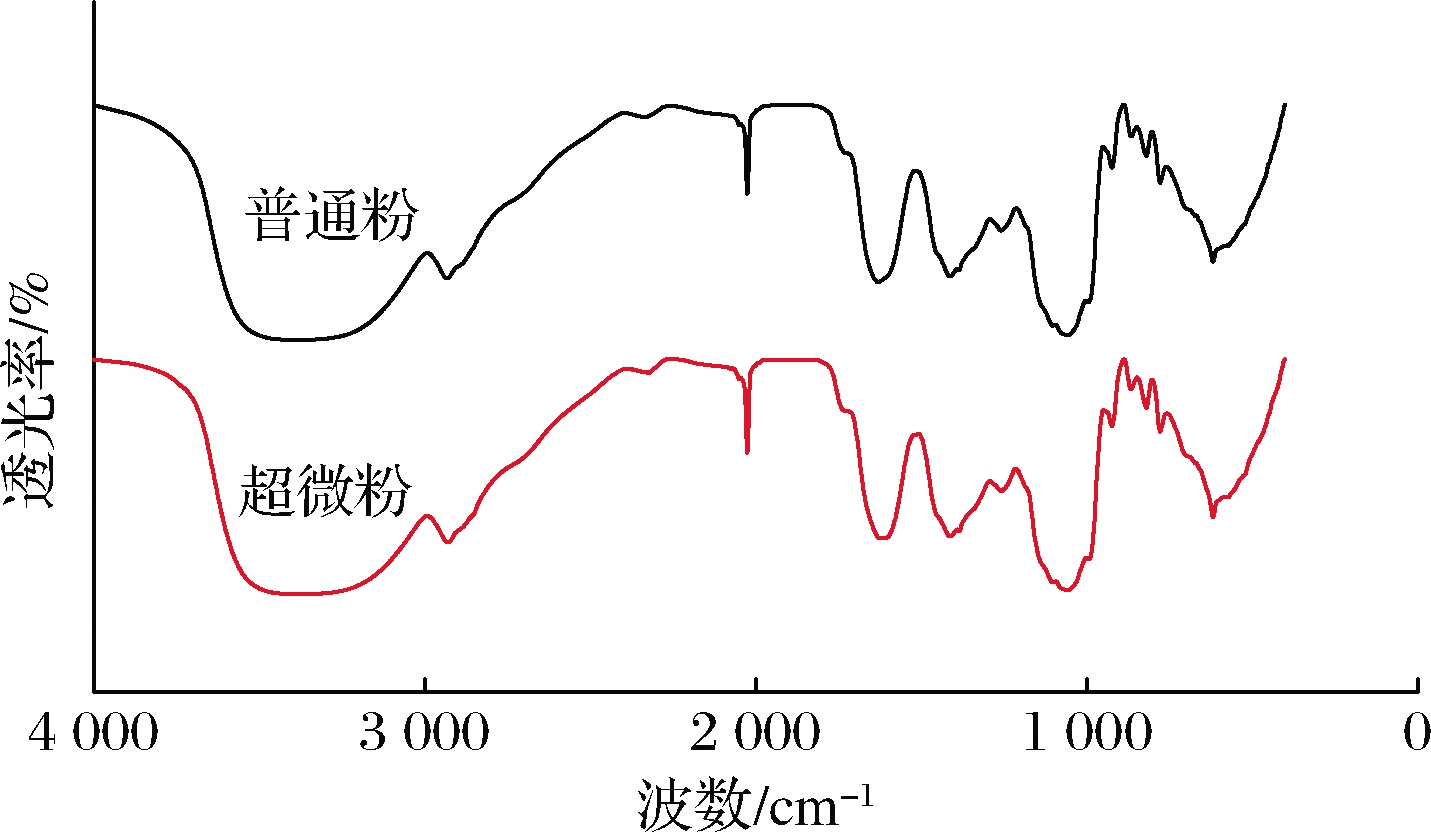
图5 超微粉碎前后枣粉的傅里叶红外光谱图谱
Fig.5 FTIR spectra of jujube powder before and after superfine grinding
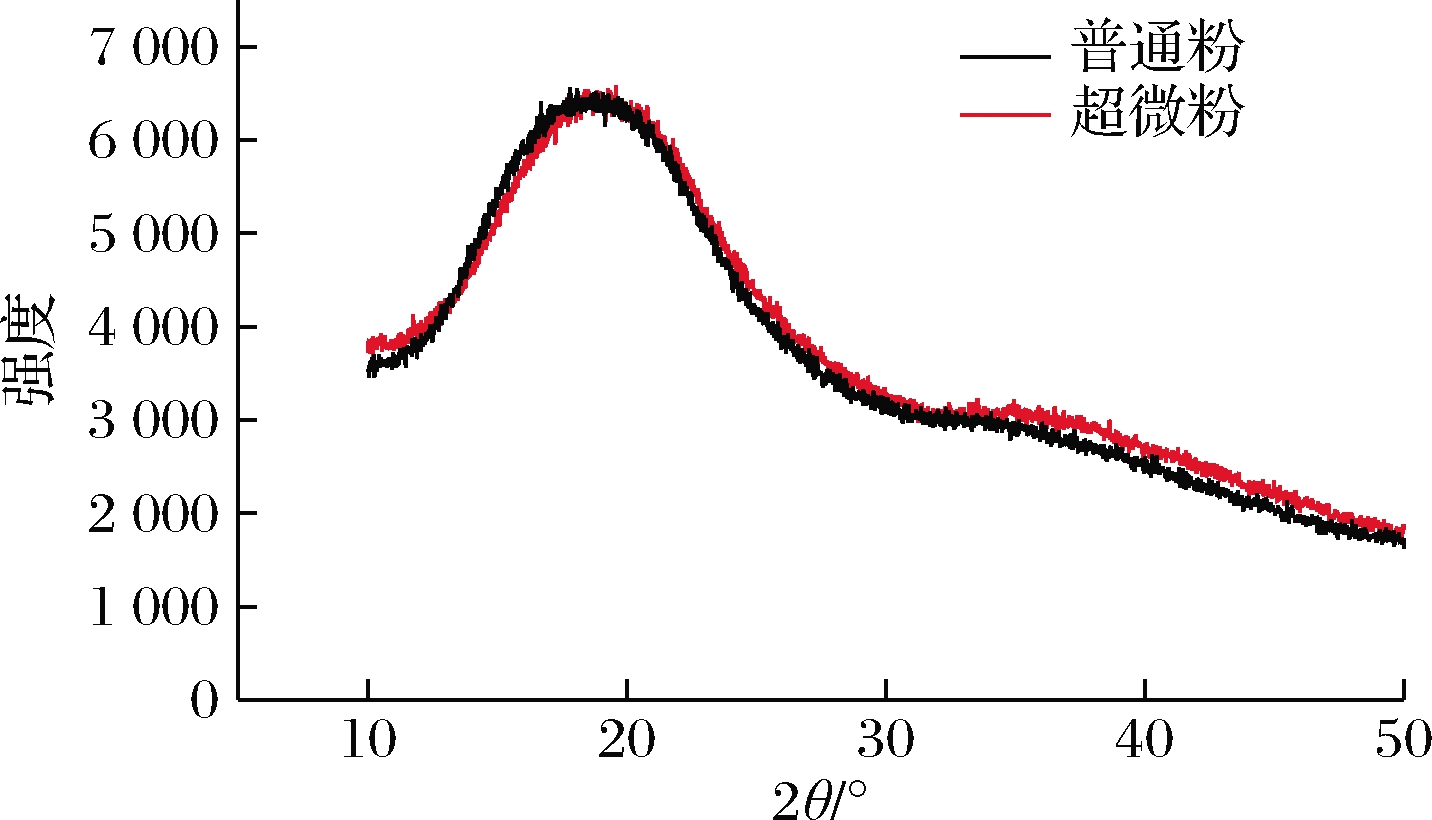
图6 超微粉碎前后枣粉的X-射线衍射图谱
Fig.6 X-ray images of jujube powder before and after superfine grinding
2.3.4 热重分析
TG曲线(图7)反映了枣粉质量随温度上升的变化。从TG曲线可知,枣粉的失重大致可分为3个阶段:50~150、150~350、350~800 ℃,失重率分别约4%、50%、15%。热重微分曲线(derivative thermogravimetry, DTG)是TG对时间的一阶导数,表示质量的变化率。从DTG曲线可以看到,2种枣粉都有2个明显的峰值,表明在这个过程中枣粉的质量明显减少。当温度<150 ℃时,不同粒径的枣粉都较稳定,其质量损失可归因于水分蒸发而导致的失重。当温度>150 ℃时,随着温度升高,枣粉的失重可能是因为一种或多种组分(多糖)的热降解及随后的挥发,以及分子层间结合水(低温峰)、胶体吸附胶体水和框架结构水(高温峰)的挥发而导致质量损失[28-29],但不同粒径的枣粉在TG、DTG曲线中都具有相似的趋势且变化较小,这与罗白玲[30]的研究结果相似。
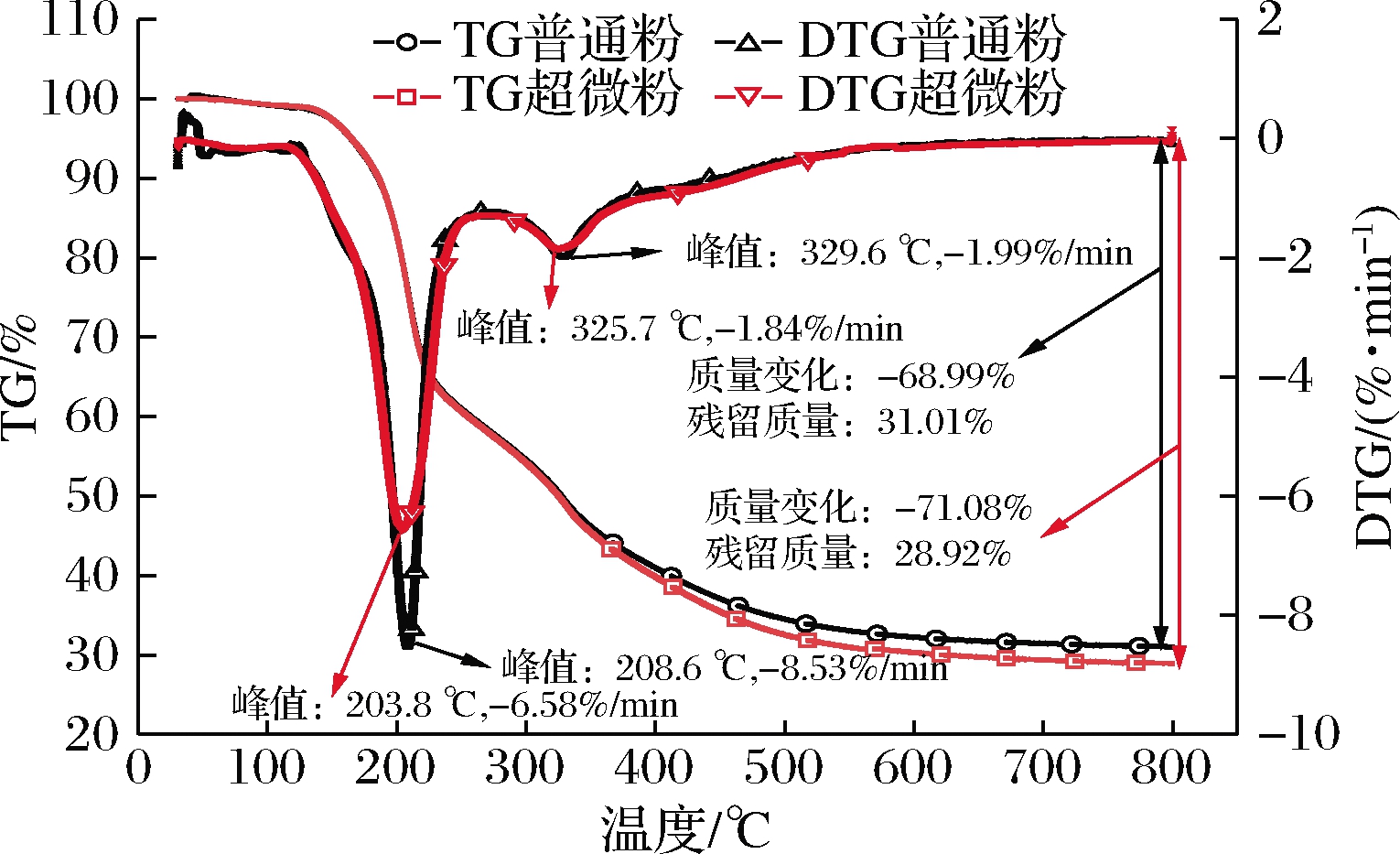
图7 超微粉碎前后枣粉的热重分析
Fig.7 Thermogravimetric analysis of jujube powder before and after superfine grinding
3 结论
本研究采用2种粉碎方式对冻干冬枣进行粉碎,探究超微粉碎对枣粉理化性质、功能特性及结构性质的影响。研究结果表明,枣粉经超微粉碎后粒径显著降低,细胞壁破碎程度显著增大,色泽更鲜艳,持油力、水溶性、溶胀性、容积密度分别提高了4.53%、7.57%、21.44%、167.65%,流动性及充填性得到显著改善;超微粉的维生素C、总糖、还原糖、总酚含量分别是普通粉的1.30、1.10、1.03、1.23倍,且抗氧化性得到显著提高;相较于普通粉,超微粉的分子结构、晶体形式及热稳定性无明显变化。
综上所述,超微粉碎在未改变枣粉分子结构、晶体形式及热稳定性的基础上,改善了枣粉的理化性质,有效地破坏了枣粉的细胞壁,进而促进枣粉的生物活性物质溶出,增强其抗氧化活性。枣粉的供应不受季节限制,贮藏运输较方便,将其加工成超微粉后可显著提升其营养价值。因此,超微粉碎可作为生产高品质枣粉的一种加工技术,提升其商业价值。超微粉碎技术在食品加工领域具有广阔的前景,本研究可为开发新型保健食品提供理论参考,为食品原料进行深加工和广度加工提供方向,以获得更多满足人们需求的理想食品资源。
- 我用了一个很复杂的图,帮你们解释下“23版最新北大核心目录有效期问题”。
- 重磅!CSSCI来源期刊(2023-2024版)最新期刊目录看点分析!全网首发!
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?
- 《农业经济》论文投稿解析,难度指数四颗星,附好发选题!
- 期刊知识:学位论文完成后是否可以拆分成期刊论文发表?
- 号外!出书的人注意啦:近期专著书号有空缺!!

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



