乳清蛋白源铜螯合肽抗氧化活性评价
乳清蛋白是由干酪生产过程中所产生的副产品乳清经过特殊工艺浓缩精制而得的一类蛋白质,具有很高的营养价值,占比为20%,其余为酪蛋白[1]。体内实验证明乳清蛋白的生物活性是因为乳清蛋白摄入后经过了消化道的降解,释放活性多肽[2]。生物活性肽的研究已成为当今多肽类药物和保健食品的研究热点。从牛酪蛋白水解中提取的抗氧化肽、抗菌肽、降血压肽、金属螯合肽等多种活性肽已被研究[3-6],铜离子是人体必需的微量矿物质,且因铜离子促氧化作用导致其与多种发病机制有关[7],铜离子螯合肽可用来治疗因铜离子过量或过少而引起的多种疾病。缺少铜离子会造成神经退行性疾病,如阿尔茨海默病和帕金森病、特发性肺纤维化和糖尿病等[8-10],铜离子过多会造成威尔逊病和不同形式的癌症[11-12]。铜离子多肽是保持铜稳态的有效工具之一[13],铜离子多肽可作为螯合剂络合体内积累过多的铜离子,也可以通过铜离子多肽螯合物对缺少的金属铜离子补充,铜离子多肽螯合物因为通过肽的吸收转运形式,所以相比较其他金属离子补充剂来说,具有生物利用度高,降低金属离子的促氧化作用,以及吸收性较好,稳定性较高的优点。
目前,大量的研究表明乳清蛋白源多肽具有抗氧化活性[14-15],而乳清蛋白源多肽与铜离子进行螯合研究较少,对乳清蛋白源铜螯合肽的活性评价更为少见,前期研究发现乳杆菌A-2在脱盐乳清粉培养基中培养获得的代谢产物具有抗氧化活性和抗肿瘤活性[16-18]。本文研究目的是采用铜离子固定化亲和层析柱和Sephadex G-15层析柱对乳杆菌A-2的代谢产物进行分离纯化,并对分离组分进行抗氧化活性评价,为合理开发利用乳清蛋白,研制高附加值的产品提供理论依据。
1 材料与方法
1.1 材料与试剂
乳杆菌A-2(Lactobacillus sp.A-2),由齐齐哈尔医学院微生态工程技术研究中心保藏;脱盐乳清粉D70(总蛋白12.0%,乳糖78%~84%),Alpavit公司(Lauben,Germany);FOCUROSE CL-6B琼脂糖凝胶,北京慧德易科技有限责任公司;Sephadex G-15葡聚糖凝胶,GE healthcare Bio-Sciences AB公司;亚氨基二乙酸(iminodiacetic acid,IDA)、荧光素钠盐(fluorescein sodium salt,FL)、(R)-(-)-环氧氯丙烷、邻苯二甲醛(1,2-phthalic dicarboxaldehyde,OPA),北京百灵威科技有限公司;ABTS、2,2′-偶氮二(2-甲基丙基咪)二盐酸盐[2,2′-Azobis(2-methylpropionamidine)dihydrochloride,AAPH]、Trolox,Sigma-Aldrich公司(St.Louis,MO,USA);蛋白非预染Marker l (4.1~66 kDa),上海生物生工有限公司。以上试剂为色谱纯,其他试剂均为分析纯。
1.2 仪器与设备
ZHWY-200D摇床,上海智城分析仪器制造有限公司;HDB-AB离子交换层析图谱采集分析仪、HDB-7T电脑高灵敏度紫外检测仪,上海沪西分析仪器厂有限公司;AKTA Explorer 100全自动蛋白层析仪,美国通用电气公司;Safire2酶标仪,Tecan集团公司;JY200C电泳仪,北京君意东方电泳设备有限公司。
1.3 乳杆菌A-2培养基制备
1.3.1 MRS(DeMan Rogosa-Sharpe)培养基
大豆蛋白胨10 g,牛肉粉10 g,酵母粉5 g,葡萄糖20 g,吐温80 0.2 mL,磷酸氢二钾2 g,无水乙酸钠5 g,柠檬酸三铵2 g,硫酸镁200 mg,硫酸锰50 mg。加水至1 L,pH 6.0~6.5,121 ℃灭菌15 min。
1.3.2 脱盐乳清蛋白粉培养基
脱盐乳清蛋白粉50 g,碳酸钙20 g,加水至1 L。121 ℃灭菌15 min。
1.4 菌株培养及代谢产物的制备
乳杆菌A-2经MRS连续扩培3次后,离心收集菌体细胞,采用等体积无菌含有10 mmol/L CaCl2的生理盐水洗涤菌体沉淀2次,经离心弃去上清液,利用上述生理盐水悬浮菌体细胞,制备菌悬液,采用分光光度计测定600 nm处菌悬液的吸光度(A600)。接种于脱盐乳清蛋白粉培养基中,使菌体终浓度为1.0 OD600/mL,于40 ℃、120 r/min振荡培养48 h,6 000 r/min离心15 min,取上清液经真空冷冻干燥获得冻干粉命名为乳杆菌A-2代谢产物。-20 ℃保存待用。
1.5 固定化亲和层析柱制备
取凝胶FOCUROSE CL-6B 50 mL,经洗涤过滤后、加入35 mL含2 g/L KBH4的1 mol/L NaOH溶液内,再加入20 mL的(R)-(-)-环氧氯丙烷为活化剂,进行凝胶活化,于37 ℃、250 r/min振荡1 h。加入100 mL的NaHCO3-Na2CO3缓冲液(0.1 mol/L,pH 9.5),20 mL 5% IDA溶液(pH 7.0)为与活化后的凝胶偶联再与金属离子络合,于37 ℃、250 r/min振荡24 h。
层析柱(1.0 cm×40 cm)洗干净,烘干,将活化后的FOCUROSE CL-6B灌入层析柱中,用200 mmol/L CuSO4溶液(5倍柱体积的量)洗涤介质;直至层析柱整体呈淡蓝色[19]。
1.6 乳清蛋白源多肽的分离纯化
1.6.1 铜离子固定化金属亲和层析柱层析
精密称取乳酸杆菌A-2代谢产物0.2 g,用5 mL 0.02 mol/L乙酸-乙酸钠缓冲溶液(pH 6.6)溶解,3 000 r/min离心3 min,重复上样循环3次,用0.02 mol/L乙酸-乙酸钠溶液(pH 6.6)冲洗2~3个柱体积、含1 mol/L NaCl的0.02 mol/L乙酸-乙酸钠溶液(pH 6.6)冲洗2~3个柱体积和纯净水冲洗2~3个柱体积,流速为0.5 mL/min。采用自动部分收集器收集分离组分,每管收集时间为10 min,以管数为横坐标,以220 nm下检测吸光度为纵坐标,绘制铜离子固定化金属亲和柱层析谱图,依次出现3个峰。根据出峰时间次序,命名为F1、F2、F3,采用OPA法跟踪检测馏分中的多肽。根据检测结果分别收集具有铜螯合活性的多肽组分,将收集的样品经旋转蒸发后,-20 ℃保存待用。
1.6.2 Sephadex G-15凝胶过滤柱层析
用Sephadex G-15(1.6 cm×100 cm)凝胶过滤柱分别对F1、F2、F3组分进行脱盐分离,用纯净水进行洗脱,流速为1 mL/min。使用自动部分收集器进行收集,每8 mL收集1管,以管数为横坐标,以214、280 nm下检测吸光度为纵坐标,绘制Sephadex G-15凝胶过滤柱层析谱图。得到组分依次命名为F1-1、F1-2、F2-1、F2-2、F3-1、F3-2。采用OPA法跟踪检测馏分中的多肽。根据检测结果进行收集,将收集的样品真空冷冻干燥、称重,-4 ℃保存待用。
1.6.3 OPA法检测多肽组分
对铜离子固定化金属亲和层析柱层析、以及Sephadex G-15凝胶过滤柱层析进行实时跟踪检测,以确定多肽组分成分,采用OPA法[20]。取30 μL样品加入到200 μL的OPA试剂中,混匀后于室温下反应2 min,通过酶标仪在发射波长为450 nm,激发波长为350 nm下测定荧光强度。
1.7 抗氧化性测定
1.7.1 ABTS阳离子自由基清除能力测定
采用ABTS法测定样品的抗氧化能力[21]。利用50 mmol/L Tric-HCl(pH 7.4)缓冲液配制待测样品溶液,经稀释制备不同浓度的样品溶液。测定时,40 μL不同浓度样品溶液分别与160 μL ABTS试剂(A734=0.80±0.1)混合,室温条件下避光反应,利用酶标仪测定反应液在734 nm处的吸光度值,反应时间为5 min。取反应第5 min时所测定的吸光度值进行计算ABTS阳离子自由基的清除率。以50 mmol/L Tric-HCl(pH 7.4)缓冲液作为空白对照,以Trolox作为阳性对照。ABTS阳离子自由基清除率计算如公式(1)所示:
ABTS阳离子自由基清除率![]()
(1)
式中:Asample和Ablank分别为样品溶液和空白对照溶液反应后在734 nm处的吸光度。ABTS阳离子自由基清除活性采用各样品溶液清除ABTS阳离子自由基50%时的浓度,即IC50表示。
1.7.2 氧自由基清除能力测定
采用抗氧化指数(oxygen radical absorbance capacity,ORAC)法测定样品清除氧自由基能力[22]。测定时利用磷酸缓冲溶液(NaH2PO4-KH2PO4、pH 7.4)对0.1 mmol/L FL溶液进行稀释制成FL工作液,使其响应值在7 000 AU左右,分别加入FL工作液80 μL、待测样品20 μL,迅速加入200 mmol/L AAPH 100 μL后,利用酶标仪,在37 ℃以激发波长485 nm,发射波长538 nm进行连续测定,每6 min测定1次各孔荧光强度,测定时间一般设定在荧光衰减呈基线后为止。以Trolox为阳性对照,相对ORAC值计算如公式(2)所示:
相对ORAC值![]()
(1)
1.8 纯化后组分分子质量测定
采用SDS-PAGE蛋白质分子质量测定[23]。使用15%分离胶和4%浓缩胶。将待测样品按体积比1∶1与上样缓冲液混合,100 ℃加热3 min,8 000 r/min离心5 min,进行上样。加样后立即开始电泳,条件为:初始电压为70 V,当样品进入分离胶后调节电压为120 V,电泳至结束。剥胶后置于培养皿中,倒入固定液固定1 h,用考马斯亮蓝染液进行染色过夜,利用脱色液[V(甲醇)∶V(冰乙酸)∶V(水)=1∶1∶8]脱色至条带清晰可见,采用凝胶成像仪扫描进行成像处理。
1.9 铜离子螯合活性的测定
配制0.625、1.25、2.5、5、7.5、10 g/L的铜离子标准溶液,以纯净水为空白对照,在632 nm处测定吸光度值,绘制标准曲线。向盛有1 mL的组分F2-1、F3-1溶液的试管中分别加入1 mL的2 mmol/L CuSO4溶液、1 mL的10%吡啶溶液和20 μL的0.1%邻苯二酚紫溶液。在632 nm处测定吸光度值[24]。螯合率计算如公式(3)计算:
螯合率![]()
(3)
式中:Ac表示空白对照吸光度,As表示样品吸光度。
1.10 统计学方法
所有的统计分析使用SPSS 25.0软件进行,实试验中每个实验值均是3次平行实验的平均值,数据以均数+标准差![]() 的形式表示,以P<0.05为差异有统计学意义。
的形式表示,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 乳清蛋白源铜离子螯合多肽分离纯化
2.1.1 铜离子固定化金属亲和层析
固定化金属亲和层析是一种用来纯化蛋白质较好的一种方法,蛋白质可以通过其表面上的暴露在外的一些氨基酸残基,例如半胱氨酸、组氨酸、色氨酸,可以与金属离子形成特异性结合位点,以此来达到分离效果,因本实验考查的目标为具有铜离子螯合活性的乳清蛋白源多肽,故采用铜离子固定化金属亲和层析柱,对乳杆菌A-2代谢产物进行分离,得到具有铜离子螯合活性乳清蛋白源多肽,进行下一步纯化。结果如图1所示。

图1 乳清蛋白源多肽经铜离子固定化金属亲和柱层析谱图
Fig.1 The chromatogram of whey protein peptide immobilized by copper ion on metal affinity column
由图1可知,乳杆菌A-2代谢产物经循环3次上样,与铜离子进行螯合,后经乙酸-乙酸钠缓冲液进行洗脱,其未吸附上的组分为渗透峰,经乙酸-乙酸钠-NaCl洗脱液液洗脱下来的组分为F1,经过纯净水,洗脱下来的组分为F2、F3。对铜离子固定化金属亲和柱层析洗脱下馏分利用OPA法每1管进行实时跟踪检测,证明3个组分均含有多肽成分。
2.1.2 Sephadex G-15凝胶过滤柱层析
经铜离子固定化金属亲和柱层析分离后,对组分F1进行Sephadex G-15凝胶过滤柱层析。结果如图2所示。
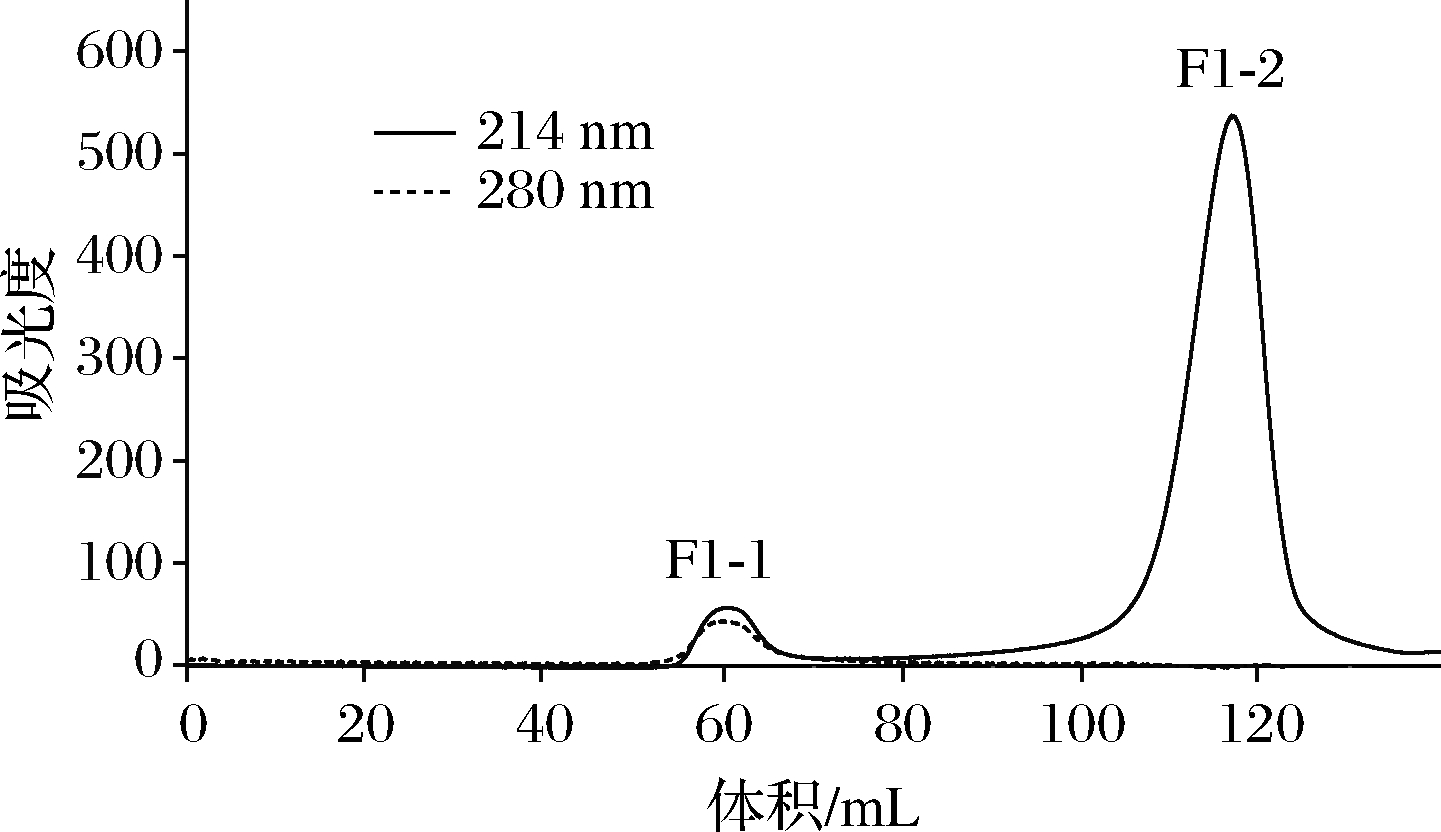
图2 组分F1经Sephadex G-15凝胶过滤柱谱图
Fig.2 Spectrogram of component F1 over gel Sephadex G-15 column
由图2可知,经铜离子金属亲和层析分离后得到组分F1利用Sephadex G-15(1.6 cm×100 cm)层析柱,以超纯水作为洗脱剂,流速为1 mL/min,利用OPA法对每1管馏分进行实时跟踪检测表明组分F1-1、F1-2均含有多肽成分。
经铜离子固定化金属亲和柱层析分离后,对组分F2进行Sephadex G-15凝胶过滤柱层析。结果如图3所示。
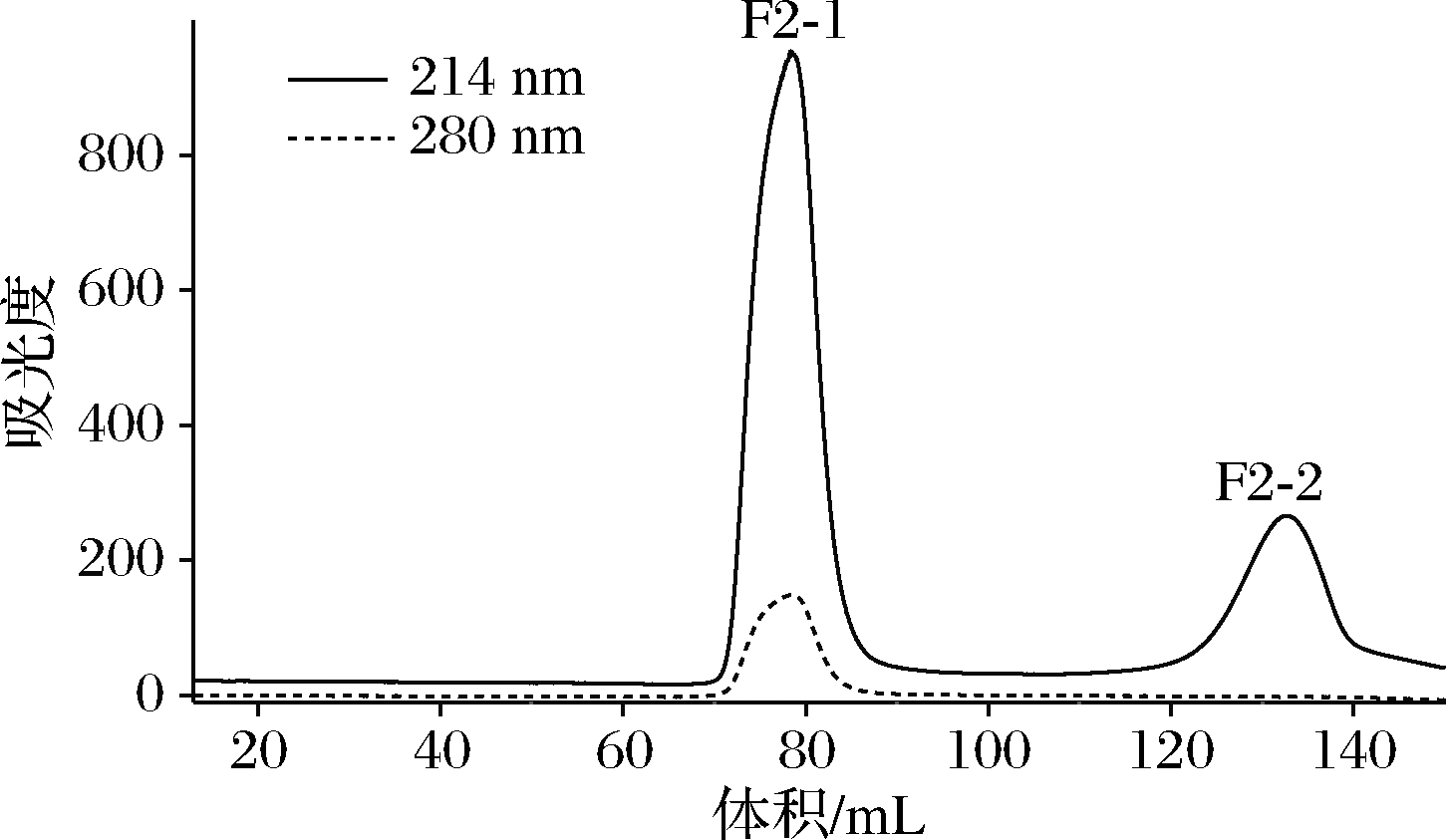
图3 组分F2经凝胶Sephadex G-15凝胶过滤柱谱图
Fig.3 Spectrogram of component F2 over gel Sephadex G-15 gel filtration column
由图3可知,经铜离子金属亲和层析分离后得到F2利用Sephadex G-15(1.6 cm×100 cm)层析柱,以超纯水作为洗脱剂,流速1 mL/min,利用OPA法每1管馏分进行实时跟踪检测表明组分F2-1、F2-2均含有多肽成分。
经铜离子固定化金属亲和柱层析分离后,对组分F3进行Sephadex G-15凝胶过滤柱层析。结果如图4所示。
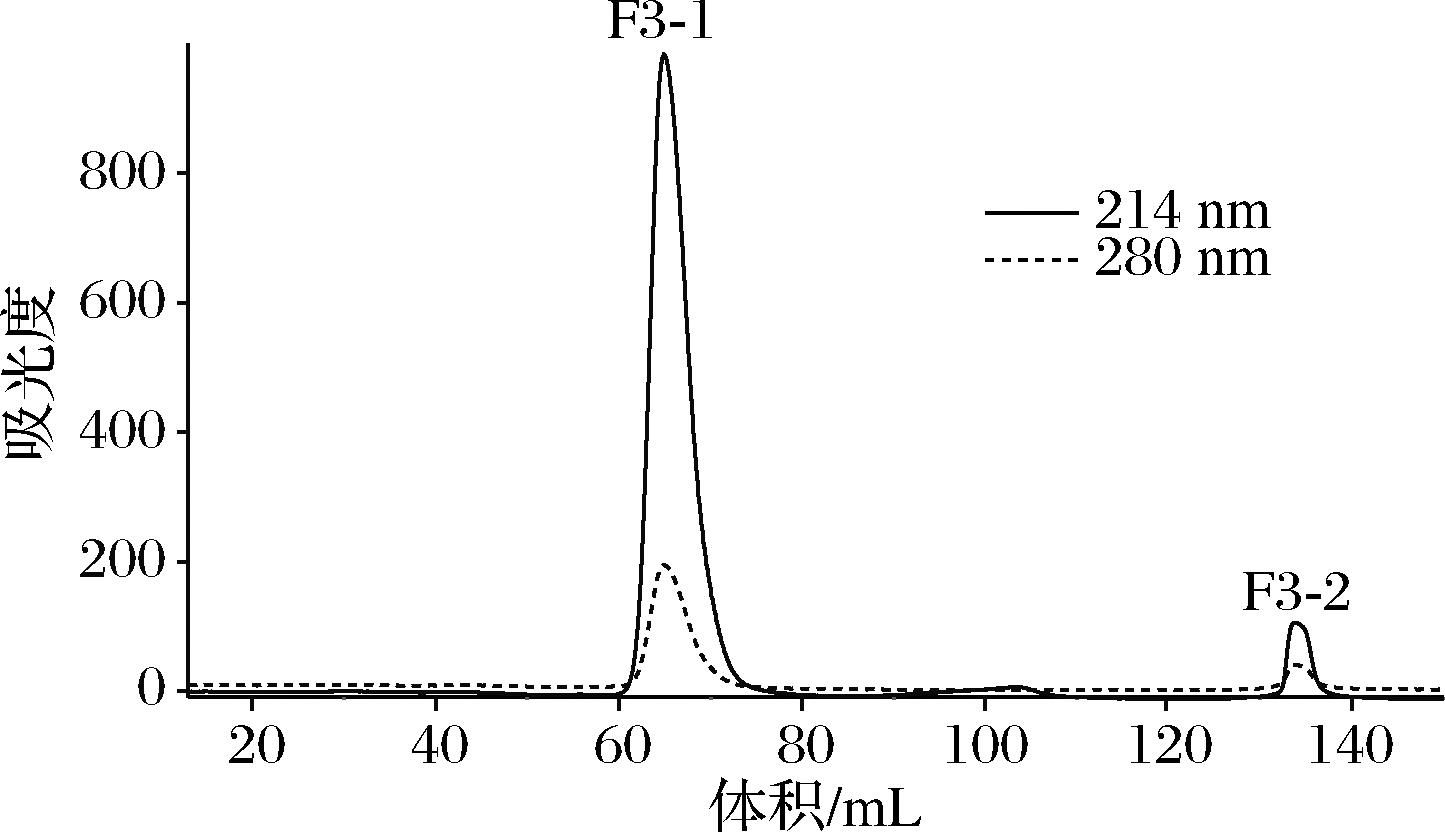
图4 组分F3过凝胶Sephadex G-15凝胶过滤柱谱图
Fig.4 Spectrogram of component F3 over gel Sephadex G-15 gel filtration column
由图4可知,经铜离子金属亲和层析分离后得到F3利用Sephadex G-15(1.6 cm×100 cm)层析柱,以超纯水作为洗脱剂,流速1 mL/min,利用OPA法每1管馏分实时跟踪监测表明2组分F3-1、F3-2均含有多肽成分。
2.2 抗氧化性测定
采用ABTS法对组分F1-1、F1-2、F2-1、F2-2、F3-1、F3-2进行抗氧化性测定,在氧化剂存在下,ABTS被氧化为绿色ABTS阳离子,测定其在734 nm处的吸光度,加入抗氧化剂后,绿色被减弱,吸光度会有所下降,可测定和计算样品的总抗氧化能力。Trolox是维生素E的类似物,可作为其他抗氧化剂总抗氧化能力的参考。并计算IC50值,结果表明组分F2-1、F3-1有良好的ABTS阳离子自由基清除能力,结果如表1所示。
表1 不同样品IC50值
Table 1 IC50 values of different samples

注:-表示未检测到IC50值,P<0.05有统计学意义
通过SPSS软件分析,组分F2-1与F3-1清除ABTS阳离子自由基能力IC50值分别为(3.068±0.15)、(5.510±1.56) g/L。由表1可知组分F1-1、F1-2、F2-2、F3-2由于洗脱剂引入盐分较多,其抗氧化活性不显著。
ORAC表示氧自由基吸收能力,又称抗氧化能力指数。其原理为AAPH热分解产生的过氧化氢自由基,以FL为荧光探针,观察自由基与荧光探针相互作用后探针荧光强度的衰减过程。以Trolox为抗氧化剂标准物质,检测体系中各种抗氧化剂延缓探针荧光强度下降的能力,评价抗氧化剂的抗氧化能力。根据测定ABTS阳离子自由基清除率结果,选择组分F2-1、F3-1进行ORAC测定。结果如图5所示。
由图5可知,测定相同浓度不同组分ORAC抗氧化能力,与阳性对照Trolox比较,且计算其相对ORAC值,最终可获得结果,组分F2-1的相对ORAC值为(1 246.59±0.72) μmol TE/g,组分F3-1的相对ORAC值为(518.83±1.15) μmol TE/g。结果表明组分F2-1、F3-1具有良好的氧自由基清除能力。
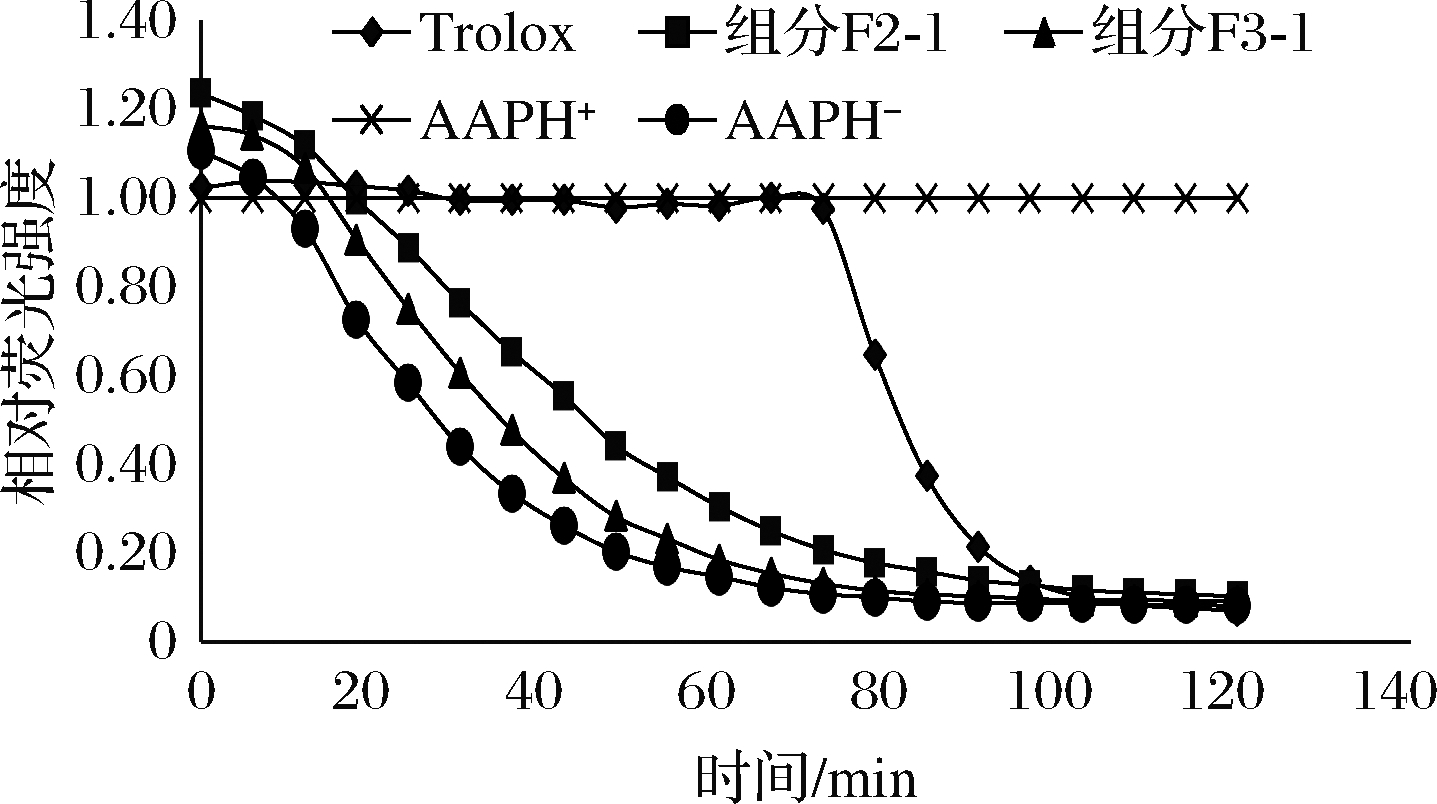
图5 组分F2-1、F3-1荧光自然衰败曲线
Fig.5 Natural decay curves of F2-1 and F3-1
2.3 纯化后组分分子质量分布图
经固定化金属离子亲和柱层析以及Sephadex G-15凝胶过滤柱层析,纯化后得到抗氧化活性较强的2个组分,分别为F2-1、F3-1,检测2个组分分子质量分布情况,结果如图6所示。

1-组分α-乳白蛋白;2-β-乳球蛋白;3-F3-1;4-F2-1
图6 组分F2-1、F3-1分子质量分布图
Fig.6 Fraction F2-1, F3-1 molecular weight distribution
如图6所示,1、2、3、4分别为组分α-乳白蛋白、β-乳球蛋白、F3-1、F2-1,已知α-乳白蛋白分子质量为14 kDa、β-乳球蛋白分子质量为18 kDa,由图6可清晰看出经分离后得的2个组分分子质量均>5 kDa。且F2-1主要成分分子质量分布在6.5~20 kDa,主要为小分子质量组分,F3-1主要成分分子质量分布在66~27 kDa,多为大分子组分。
2.4 铜离子金属螯合率测定
研究表明金属螯合肽具有抗氧化性,具有无机金属离子所不具备的生理生化特性,肽可以阻止金属在细胞中催化反应的进行,一旦络合稳定,铁、铜等金属的促氧化作用会显著降低。
通过测定不同浓度铜标准溶液吸光度,得到标准曲线y=0.063 7x+0.215 6(r=0.996 9)。根据标准曲线计算组分F2-1与F3-1与铜离子螯合率分别为(59±1.45)%、(6±0.32)%。
3 结论
目前金属螯合肽研究较多,以食源性多肽角度出发,寻找出可以与金属离子相结合,且能够作为金属离子补充剂的多肽,解决由于缺少金属离子或金属离子堆积过度而导致的疾病具有重要意义,且金属螯合肽具有抗氧化性,可以降低由于金属离子因促氧化反应。近年来无毒纯天然抗氧化剂,逐渐成为热点。本文采用乳酸杆菌A-2代谢产物,经过分离纯化出具有铜离子螯合活性的组分,并且经过ABTS法和ORAC法测定抗氧化性,组分F2-1清除ABTS阳离子自由基能力以IC50值表示为(3.068±0.15) g/L,组分F3-1 IC50值为(5.510±1.56) g/L。组分F2-1的相对ORAC值为(1 246.59±0.72) μmol TE/g,组分F3-1的相对ORAC值为(518.83±1.15) μmol TE/g,充分表明经纯化后的乳清蛋白源铜离子螯合肽属于安全无毒的抗氧化性物质,可应用于食品、药品等应用领域。但本实验未对组分进行表征,有待进一步研究。
- 我用了一个很复杂的图,帮你们解释下“23版最新北大核心目录有效期问题”。
- 重磅!CSSCI来源期刊(2023-2024版)最新期刊目录看点分析!全网首发!
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?
- 《农业经济》论文投稿解析,难度指数四颗星,附好发选题!
- 期刊知识:学位论文完成后是否可以拆分成期刊论文发表?
- 号外!出书的人注意啦:近期专著书号有空缺!!

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



