岩盐矿提钾老卤中溴离子选择性电氧化过程研究
溴是十分重要的精细化工原料,广泛应用于阻燃剂、医药、染料及感光材料等领域[1]。我国是溴素的生产大国,溴素年产量约为15万吨,约占全球溴产量的十分之一[2],但依旧不能满足我国溴资源的需求。2016年至今,我国溴素年净进口量6万吨左右,进口价格也由2016年的2801.86美元/吨逐年上涨至2021年底的5729.25美元/吨[3]。我国实际利用的溴资源主要来源于地下卤水和浓缩海水,地下卤水主要分布在四川盆地和山东莱州湾。从20世纪80年代初到2016年,我国最重要的制溴来源莱州湾地下卤水中的溴含量已经从400 mg/L降至约70 mg/L[4]。因此,寻找新的制溴原料与开发新型提溴技术具有重要意义。
在我国钾肥“走出去”战略中,数十家国内企业对中南半岛的泰国东部呵叻高原的岩盐矿进行勘探与开发[5]。在使用“旱采+选矿加工+回填”的工艺[6]对其开采利用过程中,会产生大量氯化镁母液,而这其中含有浓度约为3 g/L的溴资源[7],溴含量已远远超过国内绝大部分制溴原料,具有很高的利用价值。然而目前未有较好的技术来合理利用这些氯化镁母液,仅是将其固化回填,不但增加钾盐开发的加工成本,同时也是对宝贵资源的一种浪费。因此,有必要加强对氯化镁母液中溴等资源分离回收技术的研究,尽可能减少废弃物的直接排放,从而提高岩盐矿开采利用过程中的经济效益与环境效益。
溴素的提取方法由最开始的沉淀法[8]提溴,到后来逐渐发展出水蒸气蒸馏法[9-10]、空气吹出法[11-12],再到近几年研究较多的离子交换树脂法[13-15]、气态膜法[16-17]、液膜法[18]、溶剂萃取法[19]及电氧化法[20-21]等提溴新方法。目前,我国所有的溴素生产企业均采用空气吹出-水蒸气蒸馏法,用氯气先将溴离子氧化为溴素后进行提取。电能作为一种清洁能源,电氧化法提溴以其优异的选择性能、简捷的生产流程、清洁的生产过程和较低的能耗,受到越来越多的关注。Cohen等[20]提出物理吸附与电容去离子化的复合过程对Br-电氧化与电还原,实现溴的去除与提取,过程能耗仅为2.24 kJ/g。Sun等[22]以石墨电极为工作电极,采用电氧化的方法将返排水和采出水中的Br-(约1 g/L)氧化为Br2,实现Br-的选择性去除,理论最低能耗仅为1.3 kJ/g。张晓等[23-24]利用电氧化法成功实现了浓海水以及地下卤水中溴的选择性提取,探究了各种共存离子对过程参数调控、能耗、提溴产率等的影响,并认为含0.4 g/L溴离子与76.0 g/L氯离子的模拟地下卤水电氧化法提溴反应遵循二级反应动力学模型。因此利用电氧化法从浓海水及卤水中提溴具有理论可行性。
岩盐矿提钾老卤中Br-浓度[25](3.00 g/L)显著高于浓海水(约0.12 g/L)与地下卤水(0.10~1.70 g/L),高Br-浓度下溴的电氧化尚未见文献报道,其电氧化参数尚不明确。且其中共存Cl-的浓度(280 g/L)是上述卤水(约80 g/L)的三倍以上,会对溴离子电氧化造成干扰。因此,针对岩盐矿提钾老卤的电氧化法提溴技术仍需要进一步研究。本实验通过设计三电极体系电氧化槽,选择溴离子选择性电氧化的合适电位,并确定在该电位下的反应动力学模型;随后考察氯离子浓度、石墨电极有效面积与搅拌速率对反应速率、电流效率与单位能耗等参数的影响。通过实验所得结果,以期为电氧化法提溴技术的工业化提供指导和参考。
1 实验材料和方法
1.1 试剂
本实验使用的所有化学试剂均为分析纯,溴化钠(NaBr)、六水合氯化镁(MgCl2·6H2O)、氯化钠(NaCl)、氯化钾(KCl)、碘化钾(KI)、硫代硫酸钠(Na2S2O3)、重铬酸钾(K2Cr2O7)、磷酸氢二钠(Na2HPO4)和磷酸二氢钠(NaH2PO4)均购置于国药集团化学试剂有限公司。
1.2 实验装置
实验装置如图1所示,分为阴极室和阳极室两个部分,阳极室内装有500 ml溴离子浓度为3 g/L的模拟卤水并采用转子搅拌;阴极室装有500 ml氯化钠(10 g/L)溶液,两极室之间采用日本旭硝子公司(ASAHI GLASS CO., LTD., Japan)的Selemion® CMV阳离子交换膜隔开以避免溴离子进入阴极室。两极室均采用空气泵(Eluan JYK30,浙江永源机电制造有限公司)鼓入空气,阳极室吹出气体采用500 ml碘化钾(6.64 g/L)溶液吸收,阴极室为敞口以避免氢气聚集发生危险。
图1
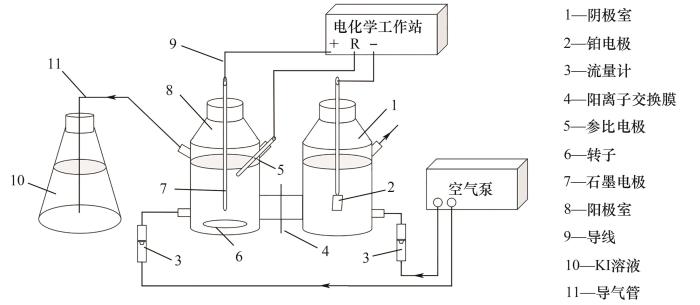
图1 三电极体系装置示意图
Fig.1 Schematic of three-electrode system
1.3 分析方法
溴离子含量分析采用电感耦合等离子发射光谱仪(ICP-OES)。仪器的测量参数设置如下:射频功率1.4 kW,雾化器流量1.0 L/min,辅助器流量1.0 L/min,冷却器流量15.0 L/min,提升量2.0 ml/min,发生器频率27.2 MHz,观测方向Axial,溴离子的检测波长选择为154.065 nm。以基体匹配法配制溴元素浓度为0、1、2、5、10、20、50 mg/L的标准溶液,建立发射光强度-溴浓度的标准曲线,测样时将样品稀释一定倍数后检测溴元素发射光强度即可得到稀释后的溴离子浓度。
溴素含量分析采用硫代硫酸钠滴定法,具体操作方法参照文献[26]。
由于反应过程中阳极室内的溶液同时含有溴素与溴离子,因此在分析时取两组待测液分别记为A与B。其中待测液A在过量硫代硫酸钠还原后使用电感耦合等离子发射光谱仪测定溴离子浓度(
氯气及氯离子的含量采用离子色谱法分析。其中在分析溶液中是否含有氯气时,先将样品酸化后用空气吹出,使用碘化钾溶液作为吸收液,通过检测吸收液中的氯离子浓度判断是否有氯气产生。
1.4 过程评价方法
电化学反应过程中的电量、电流、电势等数据均可通过电化学工作站配套使用的电化学软件(CS Studio6)实时观测,在实验结束后可从软件中导出保存并分析。
1.4.1 电流效率
电流效率指电氧化溴过程中实际溴产量与理论溴产量的比值,按照
1.4.2 单位能耗
单位能耗指电氧化溴过程中每产生单位质量的溴素所需要的能耗,按照
1.4.3 溴转化率
溴转化率η指溶液中反应的溴离子占初始溴离子的比例,按照
1.5 氧化电位确定方法
利用1.2节的实验装置,采用线性扫描伏安法(linear sweep voltammetry,LSV)分别对磷酸盐缓冲溶液(pH=7)、溴化钠溶液(1 mol/L溶于pH=7的磷酸盐缓冲溶液)、氯化钠溶液(1 mol/L溶于pH=7的磷酸盐缓冲溶液)进行伏安特性曲线测定。电极电位扫描范围为0~3 V,扫描速率为50 mV/s。根据所得曲线,得到氯离子与溴离子的氧化电位,从而确定溴离子选择性氧化的阳极电位范围。
除特别标注外,本文中所有的电极电势均以Ag/AgCl电极为参比电极,实验中所使用的参比电极相对于标准氢电极的电极电势为0.197 V。
1.6 动力学规律探索及单因素实验研究方法
动力学规律探索实验以含3.0 g/L的溴离子与280 g/L氯离子的模拟老卤为阳极电解液,阳极使用表面积为50.18 cm2的石墨电极,调整转子转速至400 r/min,在电极电势为1.150 V的条件下进行电氧化实验。实验开始后每小时取两组平行样,采用1.3节的分析方法对阳极室中的溴离子浓度进行定量分析。将所得的浓度数据分别通过零级反应动力学拟合(c-t)、一级反应动力学拟合(lnc-t)、二级反应动力学拟合(1/c-t)[27],选择线性相关系数最好的动力学模型,并以该模型的反应速率常数作为电氧化速率快慢的依据。
在单因素实验的研究中,老卤中的氯离子、工作电极有效面积、搅拌速率与pH等因素可能对电氧化过程产生影响。由于岩盐矿提钾老卤在提溴后需要进行回填,不允许回填母液的pH调至过酸性,因此在本实验中将对上述除pH外的其他因素进行单因素探究实验。氯离子浓度的研究范围为0、3、40、80、120、160、220、280 g/L;工作电极有效面积的研究范围为6.95、9.30、11.66、14.04、18.85、50.18 cm2;搅拌速率的研究范围为100、200、300、400 r/min。对比不同条件下的电氧化速率、溴转化率等条件,选择岩盐矿提钾老卤的最优电氧化条件。
2 实验结果与讨论
2.1 确定氧化电位
溴离子与氯离子的电氧化及其标准氧化电位[28]如
利用三电极体系对磷酸盐缓冲溶液、溴化钠溶液、氯化钠溶液进行线性扫描伏安法扫描,得到如图2所示的电流与扫描电压的伏安特性曲线。由图可知,溴与氯初始发生氧化的电位与文献中相差不大,两者之间的电位具有一定的差距,若选择电极电势介于溴与氯的初始氧化电位之间,即可将溴从卤水中选择性提取,而氯仍以离子形态存在于卤水中。
图2
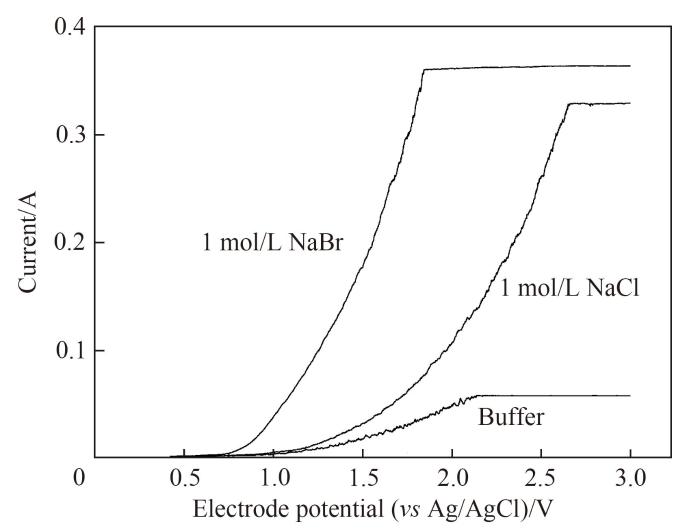
图2 不同体系线性扫描伏安法伏安特性曲线
Fig.2 Voltammetric curves of linear sweep voltammetry for different solutions
针对岩盐矿提钾老卤,卤水中溴离子浓度为3 g/L,氯离子浓度为280 g/L,在该条件下可通过
考虑到氯在石墨电极上存在约0.100 V左右的过电位[23],即当氧化电位约为1.200 V时,氯离子开始被氧化。若要选择性氧化岩盐矿提钾老卤中的溴离子,氧化电位应介于0.974~1.200 V之间。
针对上述三电极体系采用1.150 V的氧化电位进行溴选择性电氧化的可行性实验,得到如图3所示的电流与时间关系。在前2 h内,阳极室中的溶液为未加入溴化钠的模拟卤水,此时体系中的电流很小,溶液透明无颜色变化,取样后分析未检测到有氯气产生,即此时溶液中无氯离子被电氧化。在第2 h时,向阳极室内加入1.932 g溴化钠(溶解后模拟卤水的溴离子浓度为3 g/L),体系中电流从约为0 A突跃至0.04 A,阳极室溶液由无色透明逐渐变为浅绿色并最终变为红棕色,说明此时溶液中有氧化产物生成,取样分析后确定氧化产物为溴素,且没有氯气产生。
图3
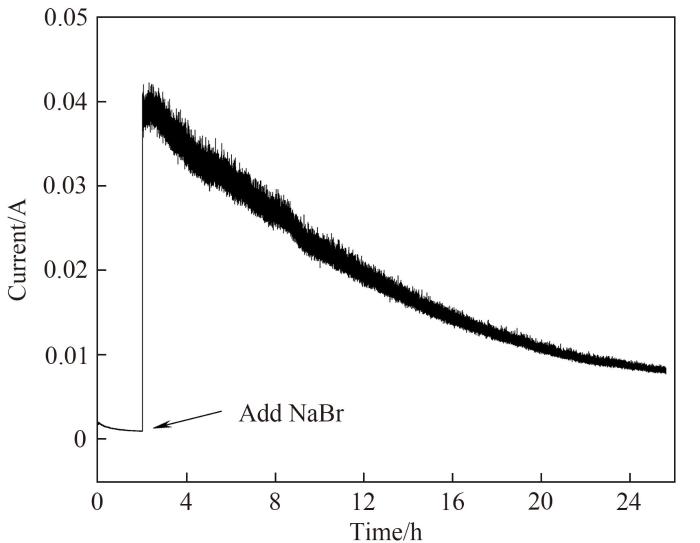
图3 模拟卤水在NaBr加入前后的电流变化
Fig.3 Current profile of simulated brine before and after NaBr addition
由上述实验数据可知,对本实验的三电极体系采用1.150 V的氧化电位进行溴选择性电氧化实验,溴离子可以被电氧化,而初始浓度是溴离子93倍的氯离子完全没有被电氧化,因此在该条件下溴离子可以从老卤中被选择性电氧化提取。后续实验将选择1.150 V的氧化电位进行最优实验条件的探索。
此时,阳极发生溴离子被氧化为溴素的反应,阴极水被还原为氢气的反应,化学式分别如
2.2 岩盐矿提钾老卤电氧化法提溴动力学研究
电氧化法作为一种提溴新技术,关于溴离子电氧化的动力学规律的研究鲜有报道,溴离子与氯离子浓度更高的岩盐矿提钾老卤电氧化法提溴的动力学规律尚未见文献报道。而动力学的研究不仅可以对溴离子电氧化的规律与机理进行探索,同时也可以为电氧化过程放大提供理论基础[30],因此对岩盐矿提钾老卤电氧化法提溴的动力学规律进行探索具有十分重要的意义。
本研究以含3.0 g/L的溴离子与280.0 g/L氯离子的模拟老卤为阳极电解液,阳极使用有效面积为50.18 cm2的石墨电极,调整转子转速至400 r/min,在电极电势为1.150 V的条件下,得到如图4(a)所示的阳极室中溴离子浓度c与电氧化时间t的关系。将所得的浓度数据分别通过零级反应动力学拟合(c-t)、一级反应动力学拟合(lnc-t)、二级反应动力学拟合(1/c-t),所得结果分别如图4(b)~(d)所示。
图4
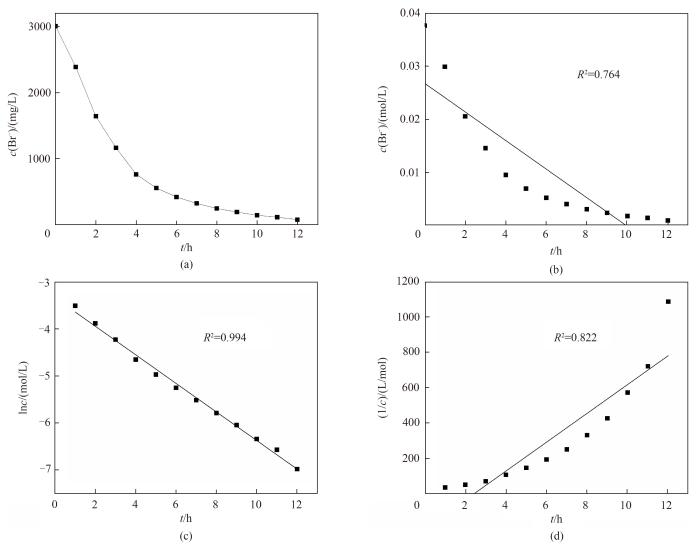
图4 (a)阳极室中溴离子浓度与电氧化时间的关系;(b)零级反应动力学模型拟合;(c)一级反应动力学模型拟合;(d)二级反应动力学模型拟合
Fig.4 (a) Changes of Br- concentration with reaction time in anode chamber;Changes of (b) c, (c) lnc and (d) 1/c with reaction time
由图可知,零级反应、一级反应、二级反应动力学拟合的线性相关系数分别为0.764、0.994和0.822,即lnc与反应时间t的线性关系最好。因此,在上述条件下进行岩盐矿提钾老卤的电氧化提溴过程更符合一级反应动力学模型,即溴离子电氧化速率与溶液中溴离子浓度成正比,模型的方程式如
该条件下动力学反应速率常数-k为0.3042 h-1。在改变电氧化体系中的不同条件时,反应速率常数也会随之增大或减小,因此后续的研究将采用一级反应动力学模型的反应速率常数来评价溴离子电氧化的快慢。
2.3 不同操作条件对提钾老卤电氧化法提溴过程的影响
2.3.1 岩盐矿提钾老卤中氯离子
在考察氯离子对岩盐矿提钾老卤电氧化法提溴过程的影响时,阳极电极采用面积为14.04 cm2的石墨电极,控制搅拌速率为300 r/min。以氯离子浓度分别为0、3、40、80、120、160、220、280 g/L配制溴离子浓度约为3 g/L的模拟卤水,在进行12 h的电氧化实验后,得到溴离子浓度和转化率随时间的变化关系,如图5所示。由图可知,不同氯离子浓度下,阳极液中溴离子浓度随着时间逐渐降低,相同时间内,溴转化率随着氯离子浓度的升高先增大后减小,当氯离子浓度为40 g/L时,12 h后溴转化率可以达到94.9%。
图5
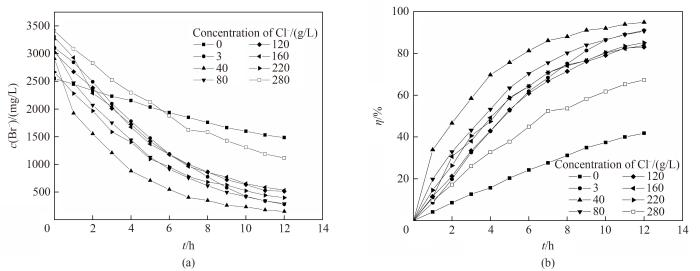
图5 不同氯离子浓度下溴离子浓度(a)和溴转化率(b)随时间的变化
Fig.5 Changes of Br- concentration (a) and bromine conversion (b) with reaction time under different Cl- concentrations
对上述数据进行一级反应动力学模型拟合,得到的结果如图6(a)所示,一级反应动力学模型拟合较好,即过程遵循一级反应动力学规律,可用一级反应的反应速率常数来评价溴电氧化速率的快慢。将得到的一级反应动力学反应速率常数对氯离子浓度作图,得到的结果如图6(b)所示。
图6
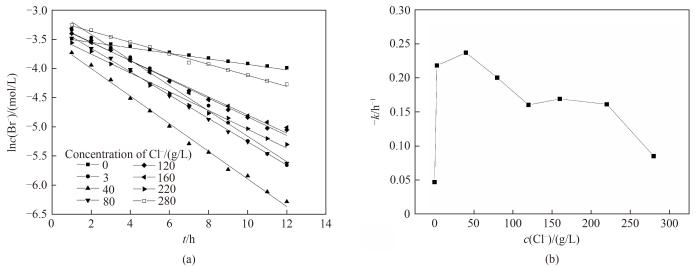
图6 不同氯离子浓度下电氧化溴离子的一级反应动力学拟合(a)和一级反应动力学反应速率常数(b)
Fig.6 Kinetic fitting of first-order reaction (a) and change of -k (b) for electro-oxidation of Br- at different Cl- concentrations
根据拟合结果可知,溴离子电氧化的速率随着氯离子浓度的升高先加快后减慢。当氯离子浓度从0增大到40 g/L时,溴离子电氧化速率逐渐加快,其原因是氯离子对溶液电导率的提升作用大于氯离子对溴离子在石墨电极上吸附的竞争作用,使得此时氯离子在该电氧化过程中起促进作用,尤其在氯离子浓度从0增大到3 g/L时,溴离子氧化速率迅速加快。当氯离子浓度达到40 g/L时,溴离子氧化速率达到最快。当氯离子浓度从40 g/L增大到280 g/L时,溴离子电氧化速率逐渐减慢,氯离子对溴离子电氧化有抑制作用[24],此时大量氯离子吸附在石墨电极表面,占据石墨电极表面溴的电氧化位点,使得溴离子电氧化反应速率迅速下降。
不同氯离子浓度条件下电流效率[
图7
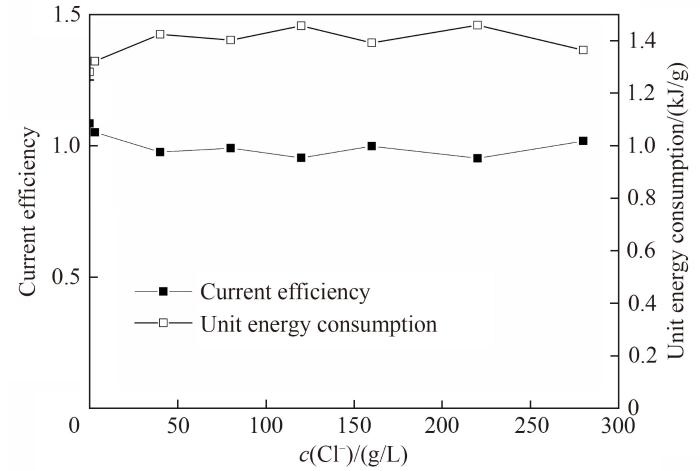
图7 电氧化溴过程电流效率、单位能耗随氯离子浓度变化关系
Fig.7 Change of current efficiency and unit energy consumption with Cl- concentrations
然而,不论是采用结晶或是其他方法从溶液中分离出氯离子都会耗费大量的能量,从能源或经济的角度而言,并不适合工业化生产。因此在后续考察中,通过增大电极面积与搅拌速率,使溴离子与石墨电极表面电氧化位点有更多的接触。
2.3.2 有效电极面积
在考察阳极石墨电极有效面积对岩盐矿提钾老卤电氧化法提溴过程的影响时,阳极液采用氯离子浓度为280 g/L的模拟卤水,控制搅拌速率为400 r/min。以阳极石墨电极有效面积分别为6.95、9.30、11.66、14.04、18.85、50.18 cm2进行12 h的电氧化实验,得到溴离子浓度及转化率随时间的变化关系,如图8所示。由图可知,改变阳极电极有效面积,阳极液中溴离子浓度均随着时间逐渐降低,相同时间内溴转化率随着阳极电极有效面积的增大而增大,当阳极面积为50.18 cm2时,12 h后溴转化率可以达到97.6%。
图8
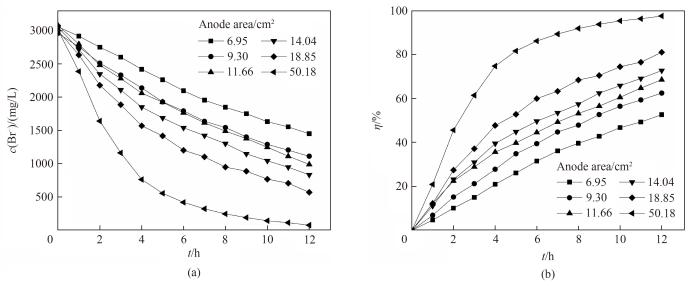
图8 不同阳极石墨电极有效面积下电氧化溴离子浓度(a)和溴转化率(b)随时间的变化关系
Fig.8 Change of Br- concentration (a) and bromine conversion (b) with reaction time under different anode electrode effective area
对上述数据进行一级反应动力学模型拟合,得到的结果如图9(a)所示,一级反应动力学模型拟合较好,即过程遵循一级反应动力学的规律,可用一级反应的反应速率常数来评价该电氧化过程的快慢。将得到的一级反应动力学反应速率常数对石墨电极有效面积作图,得到的结果如图9(b)所示。
图9
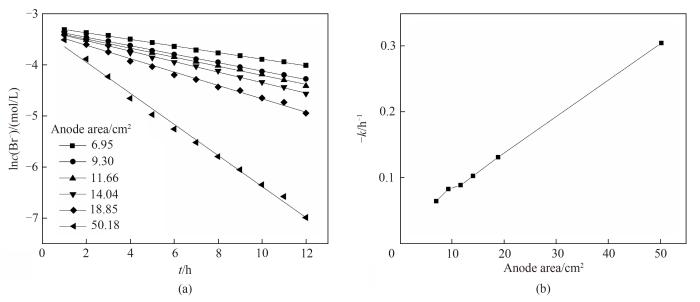
图9 不同阳极石墨电极有效面积下电氧化溴离子的一级反应动力学拟合(a)和一级反应动力学反应速率常数(b)
Fig.9 Kinetic fitting of first-order reaction (a) and change of -k (b) for electro-oxidation of Br- at different anode electrode effective area
由图可知,石墨电极的面积是反应速率常数极大的影响因素之一,且反应速率常数与石墨电极有效面积成正比,即单位面积上的溴离子反应效率不变。当增大阳极石墨电极的有效面积时,溴离子与石墨电极表面有更多的接触机会,其电氧化速率会线性上升。
石墨电极是一种生产简单、价格低廉、寿命长、可以重复使用的电极。通过适当增加电极的有效面积,以加快溴离子电氧化的速率,不论是从绿色环保或是经济的角度都是可行的。在本实验的三电极电氧化装置中,石墨电极有效面积最大可以达到50.00 cm2左右,因此选择石墨电极有效面积为50.18 cm2进行后续实验,反应速率可以达到最快。
2.3.3 搅拌速率
在考察转子的转速对岩盐矿提钾老卤电氧化法提溴过程的影响时,阳极液采用氯离子浓度为280 g/L的模拟卤水,使用有效面积为50.18 cm2的阳极石墨电极进行12 h的电氧化实验,搅拌速率分别为100、200、300、400 r/min,得到溴离子浓度和溴转化率随时间的变化关系,如图10所示。
图10
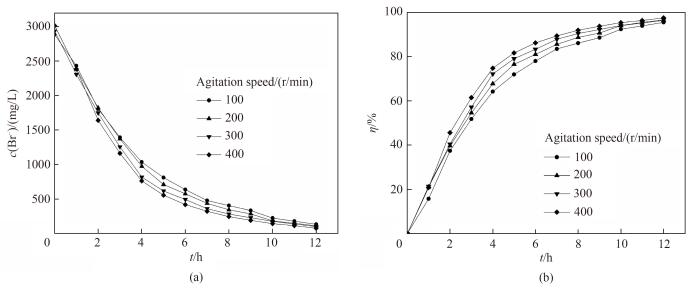
图10 不同转速下电氧化溴离子浓度(a)和溴转化率(b)随时间的变化关系
Fig.10 Change of Br- concentration (a) and bromine conversion (b) with reaction time under the different rotating speed
由图可知,不论如何改变转速,在电氧化12 h后的溴离子转化率均可达到95%以上,最高在400 r/min时可以达到97.6%。溴转化率达到85%时,转速为400 r/min所需时间约为5.5 h,比转速为100 r/min所需时间(7.5 h)少约2 h,缩短约30%。
对上述数据进行一级反应动力学模型拟合,得到的结果如图11(a)所示。该过程遵循一级反应动力学的规律,可用一级反应的反应速率常数来评价该电氧化过程的快慢。将得到的一级反应动力学反应速率常数对转子转速作图,得到的结果如图11(b)所示。
图11
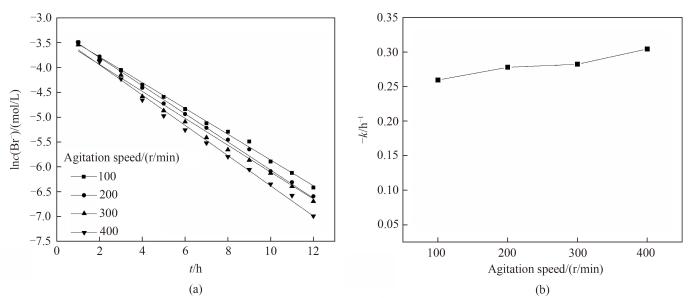
图11 不同转子转速下电氧化溴离子的一级反应动力学拟合(a)和一级反应动力学反应速率常数(b)
Fig.11 Kinetic fitting of first-order reaction (a) and change of -k (b) for electro-oxidation of Br- at different rotating speed
由图可知反应速率常数随着转子转速的加快而增大,其原因是转子转速增加会加强溴离子与石墨电极表面的传质,从而使溴离子电氧化的速率相应加快。但由于溶液中氯离子浓度远远大于溴离子浓度,且随着反应进行至溴离子转化率达到90%时,氯离子与溴离子的浓度比由最开始的约90增大到约930,因此在石墨电极有效面积不变的情况下,溴离子与石墨电极表面传质机会增加得并不显著,即溴离子反应速率随转子转速的增加有较小的加快,反应速率常数维持在0.25~0.30 h-1。
2.4 岩盐矿提钾老卤溴离子选择性电氧化操作时长选择
目前工业所采用的提溴技术均先用氯气将提溴原料中的溴离子氧化为溴素后再进行提取,根据配氯比、酸化pH等因素的不同,溴离子的氧化率一般为90%~95%[32-34]。本研究用电氧化法取代氯气氧化法,以实现氯气使用受限情况下的溴离子选择性氧化。因此对比氯气氧化,电氧化过程中溴离子的转化率期望达到90%以上,并且选择达到该目标时间最短,效率最高的电氧化条件。
通过上述实验,氯离子浓度与电极面积是该电氧化实验的重要影响因素。当氯离子浓度为40 g/L、电极有效面积为50.18 cm2、搅拌速率为400 r/min时,溴离子电氧化的速率最快。而由于将卤水中氯离子浓度从280 g/L降低至40 g/L不论是采用浓缩或是其他方法都会耗费巨大的能量,因此在该过程中不通过降低氯离子的浓度来提高反应速率。当氯离子浓度为280 g/L、电极的有效面积为50.18 cm2、搅拌速率为400 r/min时,溴离子电氧化的速率最快,此时反应速率常数为0.3042 h-1。当选择反应时长为8 h时,溴转化率为91.9%,当选择反应时长为12 h时,溴转化率可以达到97.6%。
综上所述,在石墨电极有效面积为50.18 cm2,搅拌速率为400 r/min时,控制岩盐矿提钾老卤中溴离子选择性电氧化反应时长为8 h,其溴转化率可以达到91.9%。
3 结论
本实验通过设计三电极体系电解槽,确定了溴离子选择性电氧化的合适电位,得到了在该电位下的反应动力学模型;分别考察了氯离子浓度、石墨电极有效面积与搅拌速率对电氧化反应速率的影响;为达到90%溴提取率选择了合适的操作时间,对电氧化法提溴技术的工业化提供指导和参考。
(1)结合文献以及线性扫描伏安法得到溴与氯的标准氧化电位,针对本项目溴离子浓度为3 g/L、氯离子浓度为280 g/L的岩盐矿提钾老卤,通过Nernst方程计算得到溴离子与氯离子的氧化电位分别为0.974 V与1.109 V。考虑到氯在石墨电极上约0.100 V的过电位,因此选择1.150 V作为本实验所研究的氧化电位,并通过后续的“确定氧化电位”实验证明老卤中溴离子被选择性电氧化提取的可行性。
(2)在阴、阳极分别使用铂片电极与石墨电极,搅拌转速为400 r/min,在电极电势为1.150 V的条件下进行岩盐矿提钾老卤中溴离子选择性电氧化反应。将阳极液中的溴离子浓度取对数后与电氧化时间t进行作图(即lnc-t图),其线性相关系数为0.994,该过程符合一级反应动力学反应规律,其反应动力学方程为
(3)在研究条件下,当氯离子浓度为40 g/L,电极有效面积为50.18 cm2,搅拌速率为400 r/min时,溴氧化转化率最高。针对氯离子浓度为280 g/L的岩盐矿提钾老卤,在石墨电极有效面积为50.18 cm2,搅拌速率为400 r/min时,控制选择性电氧化反应时长为8 h,溴氧化转化率可达91.9%。
符号说明
| 分别表示初始与反应结束后阳极液中的溴离子浓度,g/L | |
| 氧化电位,V | |
| Faraday常数,96500 C/mol | |
| 电氧化过程中的电流,A | |
| 反应速率常数,h-1 | |
| 溴的摩尔质量,79.9 g/mol | |
| 电氧化过程的电量,C | |
| 摩尔气体常数,J/(mol·K) | |
| 温度,K | |
| 取样时的电氧化时间,s | |
| 电氧化过程中的槽电压,V | |
| 阳极液体积,L | |
| 溴转化率,% |
- 我用了一个很复杂的图,帮你们解释下“23版最新北大核心目录有效期问题”。
- 重磅!CSSCI来源期刊(2023-2024版)最新期刊目录看点分析!全网首发!
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?
- 《农业经济》论文投稿解析,难度指数四颗星,附好发选题!
- 期刊知识:学位论文完成后是否可以拆分成期刊论文发表?
- 号外!出书的人注意啦:近期专著书号有空缺!!

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



