工业萝卜泡菜发酵过程中理化特性及真菌群落多样性分析
四川泡菜历史悠久,因其富含维生素、矿物质、有机酸和益生菌而成为家喻户晓的开胃菜和佐菜,并已从传统小型家庭作坊式生产发展为工业化大规模生产[1]。工业泡菜大多是使用食盐直接腌制新鲜蔬菜而成,而萝卜泡菜是其中的典型代表。萝卜是四川盆地种植的主要农作物之一,且萝卜泡菜由于其质地口感好、药用价值高和营养价值丰富而成为重要的发酵蔬菜之一[2]。
近年来,随着分子微生物学技术的高速发展,高通量测序技术已经广泛运用于发酵豆制品[3-5]、腐乳[6]、酱醋[7]、酸鱼[8]、发酵茶[9]和发酵蔬菜[10]等传统发酵食品的微生物群落结构分析。LIANG等[11]研究表明四川工业榨菜泡菜发酵过程中细菌是主要的活性微生物,乳酸杆菌(Lactobacillus)是发酵中后期的优势细菌属。LIU等[12]阐明了中国南方传统泡菜和北方辣白菜在细菌群落结构上的差异,且总酸、乳酸和乙酸与辣白菜细菌群落呈正相关,与传统泡菜细菌群落呈负相关。RAO等[13]研究发现在传统腌制萝卜中乳酸杆菌是优势细菌属,毕赤酵母(Pichia)和假丝酵母(Candida)是优势真菌属。吕嘉枥等[14]通过高通量测序发现不同原料的传统老坛自然发酵泡菜的真菌群落结构不同。因此现有研究大多关注于家庭泡菜中的细菌多样性,对工业泡菜和真菌多样性研究较少。迄今为止,尚未见到针对不同工艺四川工业泡菜发酵过程中的真菌多样性研究报道。
本实验采用高通量测序技术对不同工厂萝卜泡菜发酵过程中真菌多样性进行分析,同时结合理化指标的变化,揭示工业萝卜泡菜发酵过程中真菌群落结构的演替规律,以期对工业萝卜泡菜发酵工艺的全面优化和发酵过程的精准调控提供理论依据。
1 材料与方法
1.1 材料与试剂
NaOH、亚铁氰化钾、乙酸锌、冰醋酸、四硼酸钠、对氨基苯磺酸、盐酸萘乙二胺、亚硝酸钠(分析纯),成都市科龙化工试剂厂;草酸、酒石酸、乳酸、乙酸、苹果酸、琥珀酸、柠檬酸(色谱纯),天津科密欧化学试剂公司;DNeasy PowerSoil Kit试剂盒,德国QIAGEN公司;AxyPrep DNA凝胶回收试剂盒,美国Axygen Biosciences公司。
1.2 仪器与设备
PHS-3C酸度计,上海仪电科学仪器股份有限公司;WS202盐度计,上海民仪电子有限公司;LC-2030高效液相色谱仪,日本岛津公司;MyCyclerTMThermal Cycler PCR仪,美国Bio-Rad公司;DYY-5琼脂糖凝胶电泳仪,中国北京市六一仪器厂;Legend Micro 17R高速冷冻离心机,美国赛默飞公司;Illumina HiSeq 2 500测序平台,美国Illumina公司。
1.3 实验与方法
1.3.1 样品采集
采集四川眉山两个工厂(J厂和W厂)的发酵萝卜渍液进行分析,以新鲜萝卜下池经石压7 d左右出水时为取样第0天,后续第30、60、120、180、240天分别取样。取样后用冰袋迅速运回实验室置于-80 ℃冰箱备用。
1.3.2 理化指标的检测
采用pH计和盐度计分别测定pH值和盐度值;参照GB/T 12456—2008《食品总酸的测定》测定样品中总酸含量;采用盐酸萘乙二胺法测定亚硝酸盐含量。
采用高效液相色谱法测定有机酸含量。样品处理:在4 ℃条件下以10 000 r/min离心15 min,上清液用0.22 μm水系膜过滤。测定条件:色谱柱为Agilent ZORBAX-SB C18(4.6 mm×250 mm,5 μm),流动相为V(0.1%的磷酸缓冲液)∶V(甲醇)=95∶5,流速0.8 mL/min,柱温40 ℃,进样量10 μL。紫外检测器波长210 nm,通过与标准品的保留时间和峰面积的比较,对其进行定性和定量。
1.3.3 DNA提取与测序
采用DNeasy PowerSoil Kit试剂盒提取发酵萝卜渍液中微生物总DNA。使用ITS真菌通用引物:ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′),ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)对总DNA进行PCR扩增。扩增体系为:5 μL Q5反应缓冲液(5×),5 μL Q5保真GC缓冲液(5×),0.25 μL 高保真DNA聚合酶(5 U/μL),2 μL(2.5 mmol/L)三磷酸碱基脱氧核苷酸(dNTPs),前后引物各1 μL(10 μmol/L),2 μL DNA模板,8.75 μL ddH2O。扩增程序为:98 ℃预变性2 min,98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,循环35次,最后72 ℃延伸5 min。PCR扩增产物经2%琼脂糖凝胶电泳检测。采用AxyPrep DNA凝胶回收试剂盒回收纯化PCR产物,用ABI Step OnePlus实时荧光定量PCR仪进行定量检测,送至上海派森诺生物科技有限公司进行测序,测序平台为Illumina HiSeq 2500。
1.3.4 测序数据分析
用QIIME计算Alpha多样性,包括 Chao1、Simpson、Shannon和Good′s coverage,以表征真菌群落结构的丰富度和多样性。使用非加权组平均法(unweighted pair-group method with arithmetic mean, UPGMA)构建树状结构。结合UNITE数据库(Release 8.0, http://unite.ut.ee/)进行物种注释。
2 结果与分析
2.1 工业萝卜泡菜发酵过程的理化指标分析
总酸(total acid,TTA)和pH是衡量泡菜发酵程度的重要指标。如图1所示,在发酵刚启动时,两厂的萝卜泡菜的总酸含量较低,从60 d时开始迅速升高,直至240 d达到最高点,pH则与总酸含量趋势相反,在整个发酵过程中逐渐降低,到发酵终止时在4.0左右。由图1-a、图1-b可知,0 d时J厂母水的pH(6.37)要高于W厂(5.30),J厂总酸含量(1.33 g/kg)却高于W厂(0.06 g/kg),猜测与2个工厂的萝卜在封池前堆放的时间有关。盐度在一定程度上决定了泡菜的品质。由图1-c、图1-d可知,发酵前60 d,两厂萝卜泡菜的盐度不断增加,最高到15%左右,随后基本维持稳定,但J厂的盐度始终高于W厂,这会抑制一些不耐盐微生物的生长,导致两厂真菌群落结构的差异。亚硝酸盐含量在两厂的萝卜泡菜中均呈波动变化的趋势,发酵后期基本维持在8.34 mg/kg(J厂)和5.44 mg/kg(W厂),低于国标中的20 mg/kg的限量标准。除0 d外,J厂的亚硝酸盐含量均高于W厂。
有机酸是四川泡菜发酵中的重要呈味物质,且与微生物代谢活动密切相关。两厂萝卜泡菜发酵过程中的有机酸含量变化如表1所示,共检测到7种有机酸,其中,含量最高的是来自萝卜泡菜原料中的草酸。随着发酵的进行,萝卜和母水中存在的丰富微生物开始生长代谢,草酸被不断分解,含量逐渐降低,而乳酸和乙酸含量明显增加,并且在发酵后期乳酸浓度是所有有机酸中最高的。这和工业豇豆泡菜[15]的研究结果一致。240 d时J厂的乳酸含量增加到9.82 g/kg,占整个有机酸总量的29.13%,W厂到240 d时乳酸含量为5.64 g/kg,占24.73%。萝卜泡菜在发酵120 d时才产生酒石酸,随后J厂酒石酸含量从0.31 g/kg增加到1.93 g/kg,W厂则在3.83 g/kg处小幅波动。柠檬酸和琥珀酸在两厂的发酵过程中均呈先增加再减少的趋势,而有较大差异的苹果酸在J厂含量最高为2.82 g/kg(120 d),在W厂为1.71 g/kg(240 d)。

a-TTA;b-pH;c-盐度;d-亚硝酸盐含量
图1 工业萝卜泡菜发酵过程中TTA、pH、盐度及亚硝酸盐含量的动态变化
Fig.1 Dynamic changes of TTA, pH and the contents of salinity, nitrite during the fermentation of industrial radish paocai
表1 工业萝卜泡菜发酵过程中有机酸含量的变化 单位:g/kg
Table 1 Changes of organic acid contents during the fermentation of industrial radish paocai
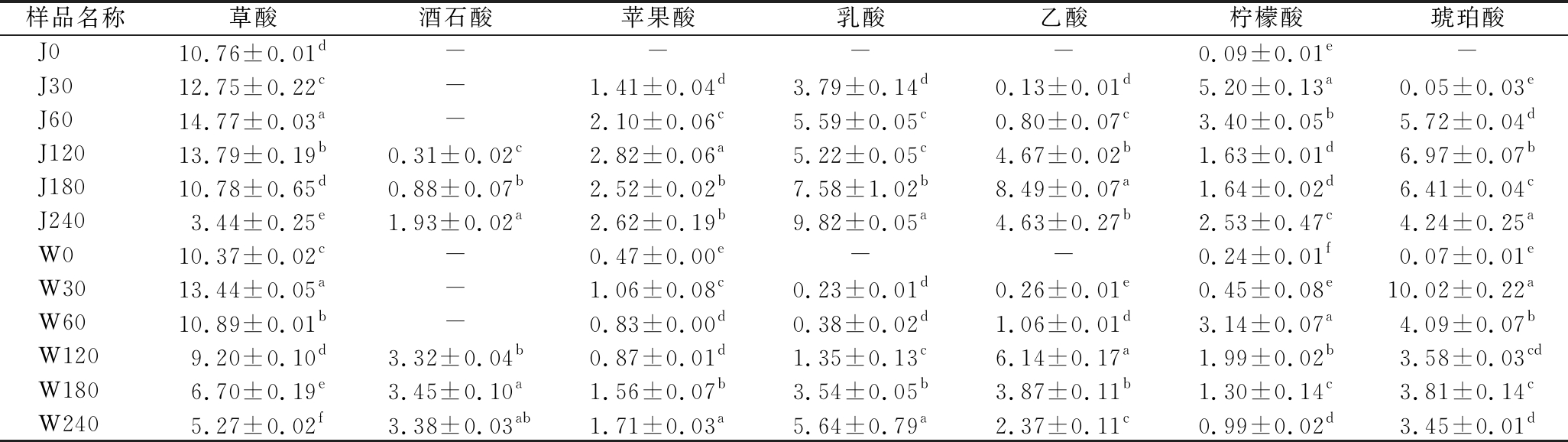
注:“-”表示未检测到;不同小写字母表示差异显著(P<0.05)
2.2 Alpha多样性分析
通过Illumina Miseq测序,为了保证样本测序序列的均一性,对所有样品有效序列按最小样本序列数进行抽平(每个样本45 629条有效序列)。抽平后,所有样品序列归属于12个门,37个纲,74个目,176个科,299个属,480个种。Alpha多样性指数,包括Chao1、Simpson、Shannon和Good′s coverage,常用于表征在环境中微生物群落的丰富度以及多样性情况。每个样品的Good′s coverage值均达0.999 9,表明测序深度良好,可以较真实展示样品中的绝大多数真菌的群落结构(表2)。J厂萝卜泡菜的Chao1指数随着发酵的进行先增加后减少,在发酵60 d时真菌群落丰富度达到最高。而W厂发酵第0天的Chao1指数最大且高于J厂,表明W厂在发酵第0天真菌群落丰富度最高,经过发酵作用后菌群丰富度有所降低。J厂的Simpson和Shannon指数值随着发酵呈下降趋势,W厂的真菌群落多样性变化趋势则与丰富度类似,这可能是由于不同工厂发酵初始母水的酸度和盐度不同。
2.3 Beta多样性分析
在真菌操作分类单元(operational taxonomic unit,OTU)分类水平上,对J厂和W厂不同发酵时期萝卜泡菜样品进行主成分分析(图2),以样本点之间的距离来衡量其真菌群落结构组成的相似或差异程度。不同样本真菌群落结构信息主要集中在前3个主成分,其累计方差贡献率为84.45%,PC1的贡献率为49.18%, PC2的贡献率为24.43%。其中,PC1可以区分不同发酵时间工业萝卜泡菜真菌群落结构的差异性,PC2可以区分不同工厂的工业萝卜泡菜样品。分析发现36个样品出现明显的聚类趋势,可将整个发酵过程分为发酵起始点(0 d)、前期(30~60 d)、中期(60~180 d)和后期(180~240 d)。
表2 Alpha多样性指数分析
Table 2 The analysis of Alpha diversity estimators
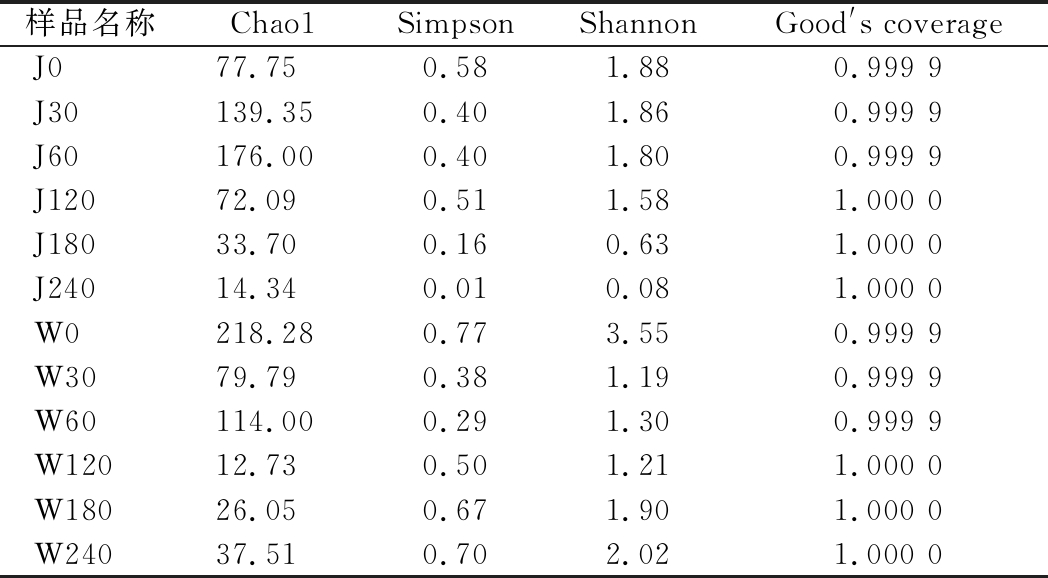
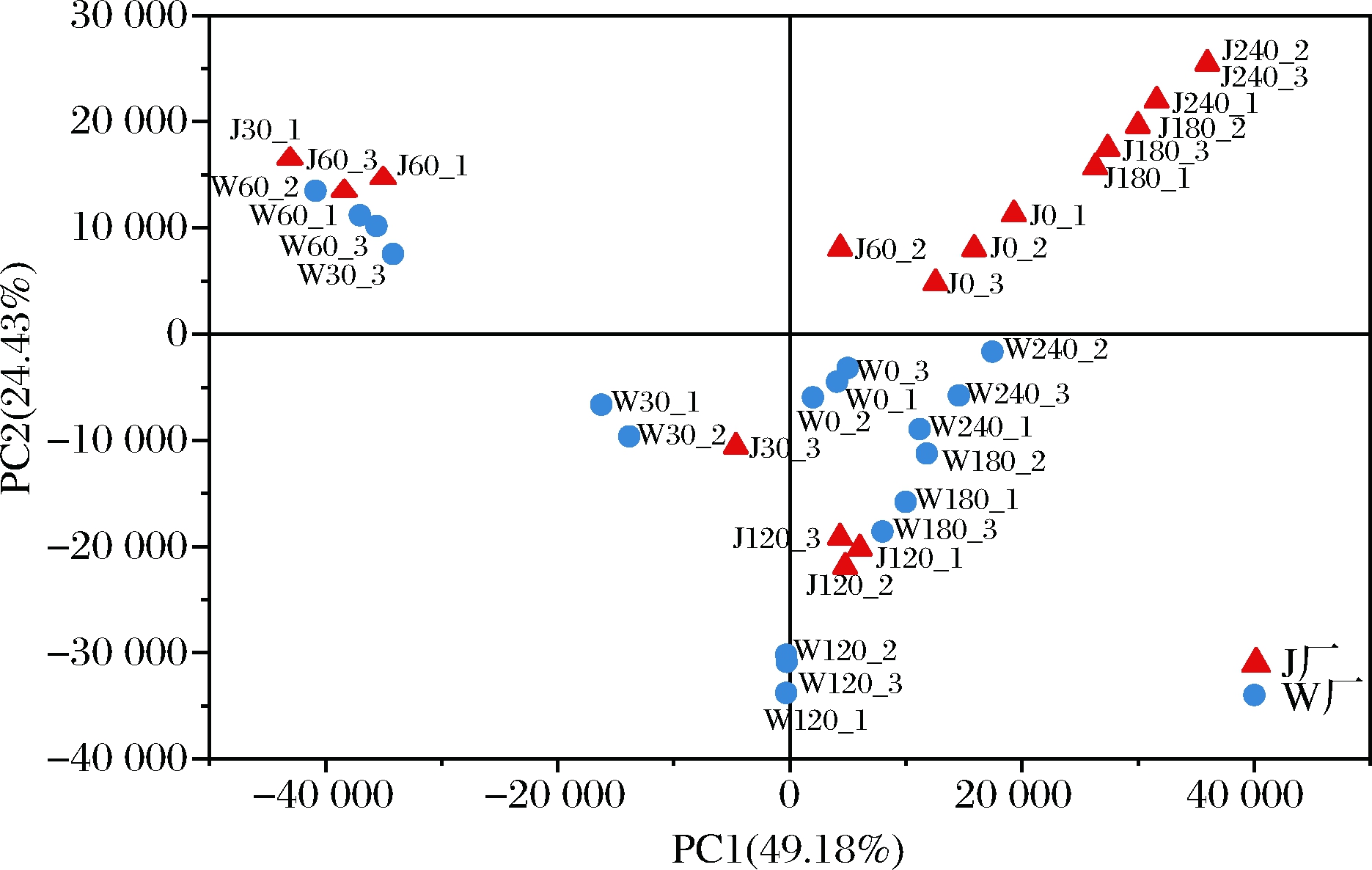
图2 工业萝卜泡菜真菌群落主成分分析
Fig.2 Principal component analysis of fungi community structure in industrial radish paocai
2.4 真菌群落结构多样性和演替规律分析
在门水平上,各厂不同发酵时期萝卜泡菜样品真菌群落组成如图3-a所示。去除未分类的真菌后,所有样品中真菌群落共包含10个门,其中子囊菌门(Ascomycota)为绝对优势菌门,相对丰度为42.7%~99.9%。其次为担子菌门(Basidiomycota),其相对丰度为 0.01%~56.9%,这与吴进菊等[16]在发酵大头菜的研究结果一致。在两个不同工厂萝卜泡菜中,担子菌门在发酵前期相对丰度较高,且均呈先增后减的趋势,W厂发酵第0天和第30天担子菌门的相对丰度超过50%,而J厂在第0天时相对丰度仅为4.58%,随后增加到27.66%(30 d)。发酵到120、180、240 d 时,则子囊菌门(99%)主导了整个发酵中后期。
在两厂36个萝卜泡菜样品中共鉴定出230个属,其中样品J60-2检测到属水平微生物数量最多(106个),W120-3检测到属水平微生物数量最少(5个)。选取其相对丰度较高的前20个优势属(至少占每个样品总相对丰度85%以上),包括假丝酵母属(Candida)、Starmerella、德巴利氏酵母属(Debaryomyces)、Tausonia、梗孢酵母属(Sterigmatomyces)和毕赤酵母属(Pichia),各厂萝卜泡菜发酵过程中优势属的动态变化如图3-b所示。假丝酵母属在两厂发酵过程相对丰度中先减后增,萝卜泡菜发酵前期的优势属为德巴利氏酵母属,假丝酵母属和德巴利氏酵母属是泡菜中常见的真菌属[17-18]。
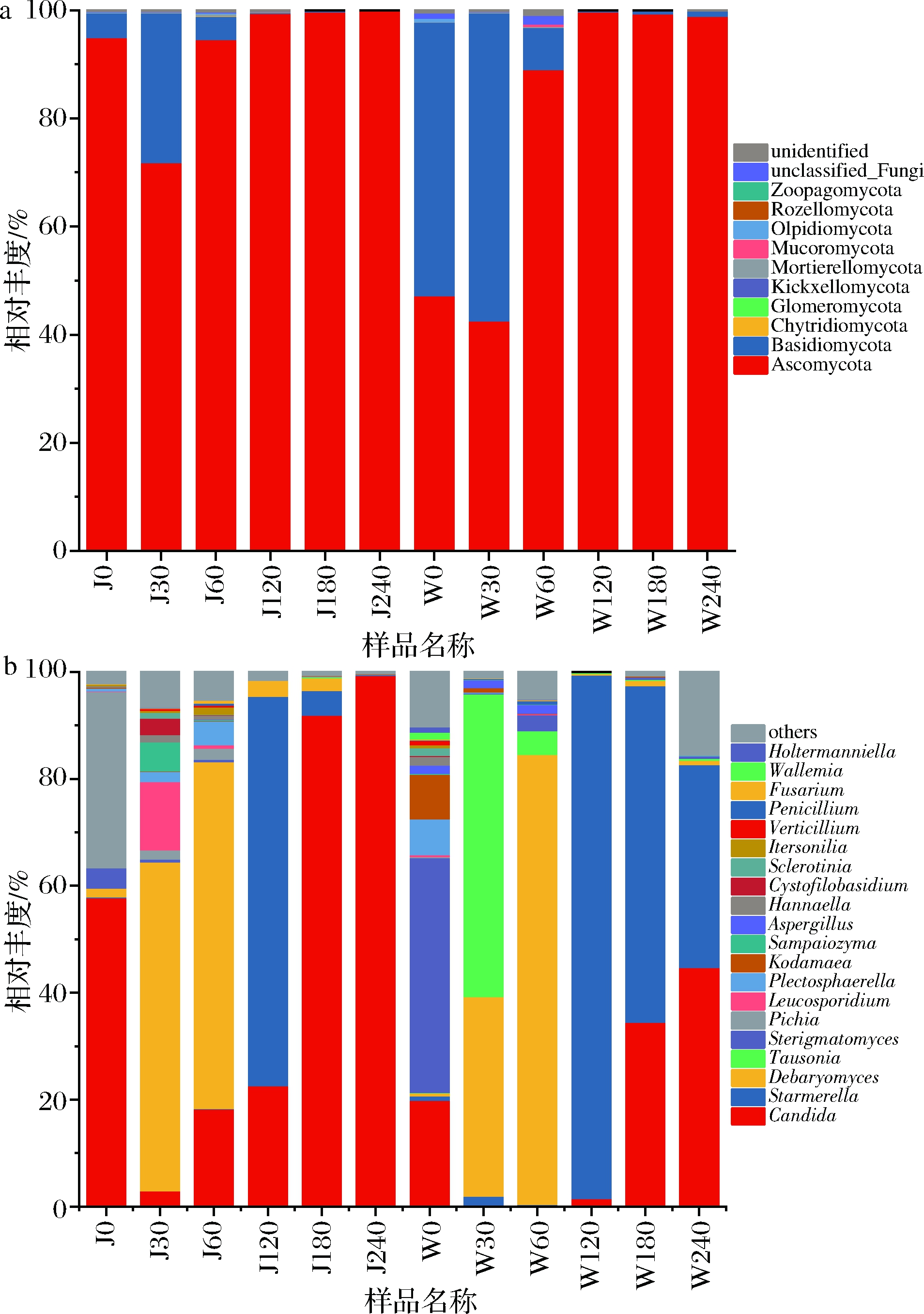
a-门水平;b-属水平
图3 门水平及属水平上工业萝卜泡菜真菌群落结构多样性
Fig.3 Diversity of fungal community structure of industrial radish paocai based on phylum and genus level
由图3-b可知,J工厂萝卜发酵过程优势菌属为假丝酵母属(3.02%~99.38%)、德巴利氏酵母属(0.05%~64.83%)、毕赤酵母属(0.04%~33.01%)和Starmerella(0.04%~72.75%)。发酵第0天,假丝酵母属(57.84%)和毕赤酵母属(33.01%)为J厂母水中的优势微生物,随后显著下降,同时德巴利氏酵母属迅速成为发酵前期的优势属。Starmerella在发酵120 d相对丰度很高(72.75%),随后减少。毕赤酵母属是J工厂萝卜0 d特有的优势真菌属,适合在弱酸环境中生存,也具有一定的产膜能力[19];Starmerella在以往泡菜的研究中很少出现,在发酵葡萄酒中出现较多,对腐败微生物有一定的抑制能力[20]。
由图3-b可知,W工厂萝卜发酵过程优势菌属为梗孢酵母属(0.04%~43.88%)、假丝酵母属(0.26%~44.76%)、德巴利氏酵母属(0.29%~84.13%)、Tausonia(0.09%~56.68%)和Starmerella(0.25%~97.92%)。与J厂不同的是,W厂发酵第0天物种丰富度最高,且优势真菌属为梗孢酵母属(43.88%)。发酵前期除德巴利氏酵母属外,Tausonia在30 d相对丰度占56.68%,随后骤降。Starmerella在发酵中期为绝对优势真菌属(97.92%),后期随着假丝酵母属的活跃而相对丰度略有降低。梗孢酵母属和Tausonia分别是W工厂萝卜0、30 d特有的优势真菌属,其中梗孢酵母属在白酒大曲和红曲醋醅中有报道出现[21-22],Tausonia在土壤微生物的报道中出现过[23-24],可能是新鲜萝卜本身携带进入发酵池。
2.5 真菌群落和理化因子关联性分析
将不同工厂萝卜泡菜4个理化指标(pH、TTA、盐度、亚硝酸盐)和7种有机酸作为环境因子,同时各自选取相对丰度较高的10个真菌属,进行冗余分析(redundancy analysis, RDA),分析结果见图4。在RDA图中各环境因子箭头越长表示对微生物群落结构的影响越大。箭头连线与排序轴的夹角以及箭头连线之间的夹角表示相关性,锐角表示正相关,钝角表示负相关[25]。TTA(45.3%)和pH(29.1%)对J厂萝卜泡菜发酵过程中真菌群落结构影响较大,TTA与假丝酵母属呈显著正相关(P<0.05),柠檬酸与德巴利氏酵母属呈显著正相关;酒石酸(51%)是驱动W厂萝卜泡菜真菌群落结构变化的主要因素,草酸与Tausonia呈显著正相关。总的说来,pH、盐度、柠檬酸和草酸与发酵前期的真菌群落结构呈正相关,苹果酸、乙酸与发酵中期呈正相关,TTA、亚硝酸盐、乳酸和酒石酸与发酵后期呈正相关。
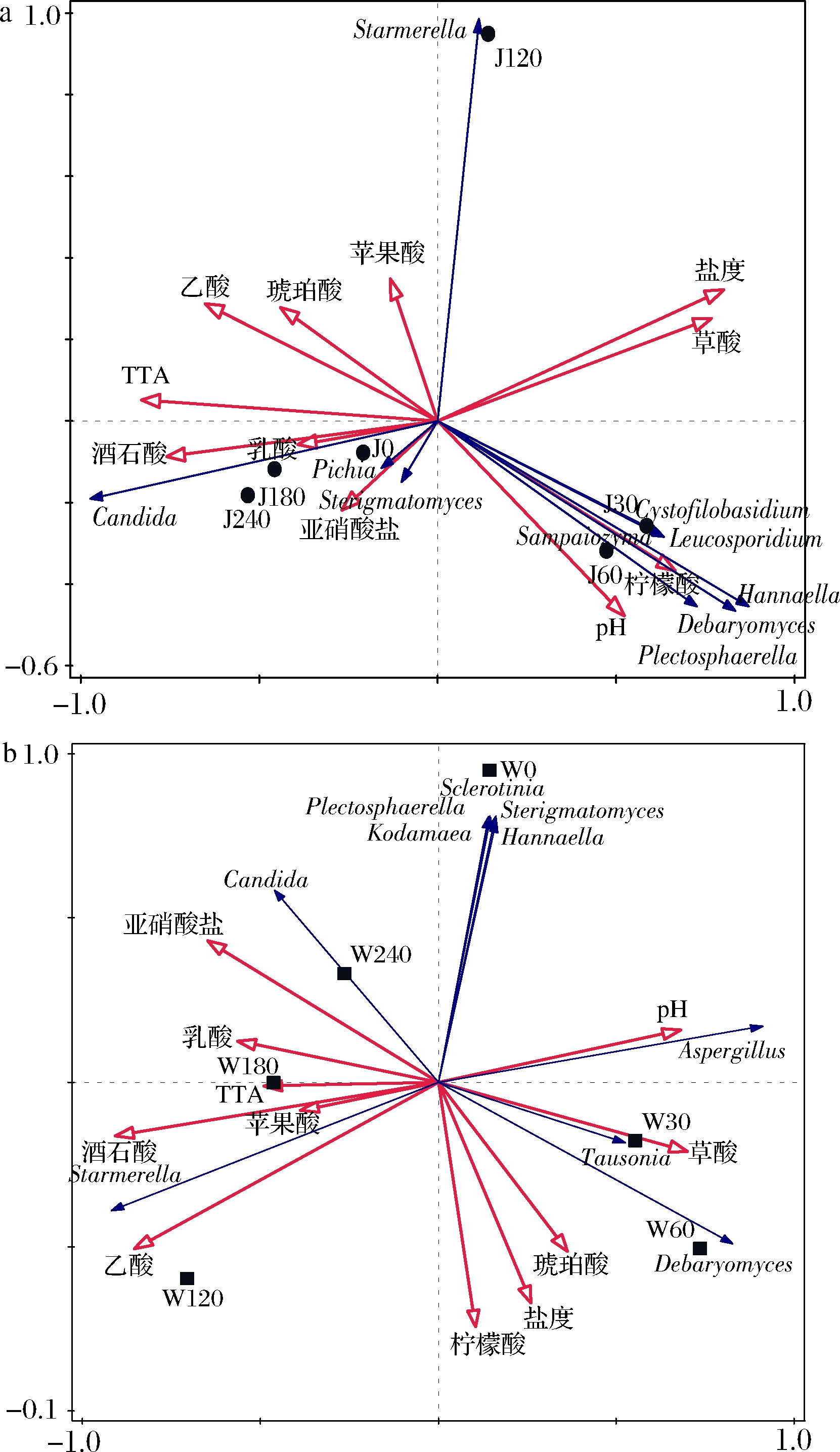
a-J厂;b-W厂
图4 工业萝卜泡菜真菌群落的冗余分析
Fig.4 The redundancy analysis of fungi in industrial radish paocai
3 结论
本研究采用高通量测序对J厂和W厂发酵过程中萝卜泡菜的真菌多样性和群落结构的演替规律进行研究。在发酵过程中,两厂的萝卜泡菜总酸浓度不断增加,pH和草酸含量逐渐下降,盐度先升高后缓慢降低,而J厂的亚硝酸盐和乳酸含量高于W厂,后者pH、盐度和乙酸含量更高。经OTU分析,36份样品中共发现12个门,37个纲,74个目,176个科,299个属,480个种。通过主成分分析发现,36个样品可根据真菌群落结构特征将发酵的整个过程分为4个不同的阶段。所有样品中的优势菌门均为子囊菌门,其次为担子菌门。属水平上,假丝酵母属在两厂发酵过程中相对丰度先减后增,德巴利氏酵母属在萝卜泡菜发酵前期是优势属,发酵中期优势属为Starmerella。毕赤酵母属是J厂发酵0 d特有的优势真菌属,梗孢酵母属和Tausonia分别是W工厂萝卜0、30 d特有的优势真菌属。此外,RDA表明,pH、盐度、柠檬酸和草酸与发酵前期的真菌群落结构呈正相关,苹果酸、乙酸与发酵中期呈正相关,TTA、亚硝酸盐、乳酸和酒石酸与发酵后期呈正相关。本研究揭示了不同生产工艺对四川工业萝卜泡菜真菌群落结构及其动态变化的影响,为工业萝卜泡菜发酵工艺的优化提供一定的理论基础,同时对今后四川泡菜的工业化、标准化生产具有重要的意义。
- 我用了一个很复杂的图,帮你们解释下“23版最新北大核心目录有效期问题”。
- 重磅!CSSCI来源期刊(2023-2024版)最新期刊目录看点分析!全网首发!
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?
- 《农业经济》论文投稿解析,难度指数四颗星,附好发选题!
- 期刊知识:学位论文完成后是否可以拆分成期刊论文发表?
- 号外!出书的人注意啦:近期专著书号有空缺!!

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



