益生菌发酵豆乳对提高结合态大豆异黄酮转化的效果
大豆富含维生素、异黄酮、蛋白质、膳食纤维及不饱和脂肪酸等营养物质,是人类主要的植物蛋白来源之一[1]。豆乳是大豆经过加工后获得的一种饮料,因其具有独特的风味、营养物质丰富且易吸收而深受大众喜欢。对于营养不良的人群以及牛奶供应不足的人群来说,豆乳蛋白的营养价值高且更容易被人体吸收[2]。益生菌为一类对机体有益的活性微生物,可以平衡机体肠道内菌群,同时也可以产生活性物质,促进人体健康[3]。乳酸菌是一类存在于人体胃肠道中的多效益生菌,可以降低胆固醇水平,具有抵抗低酸碱度和高胆盐的能力,研究价值非常高[4]。发酵豆乳由灭菌豆乳经过益生菌发酵而形成,其具有豆香味,保留了豆乳原有营养价值的同时减少了高脂饮食引起的高脂血症和肝损伤[5],可改善低聚糖的消化率[6-7],同时减少草酸、植酸、蛋白酶抑制剂、脲酶等抗营养成分[8-9]。此外,通过益生菌的发酵,可将结合型的大豆异黄酮转化为更易被人体消化吸收的游离型大豆异黄酮[10-11]。大豆异黄酮被称为天然植物雌激素,虽然对机体健康有益,但主要是以结合态的大豆异黄酮存在,即为糖苷形式,难以被人体消化吸收[12]。当人体摄入含有大豆异黄酮的食物后,游离型的大豆异黄酮可直接在小肠被吸收,而结合型的大豆异黄酮则在肠道中被β-葡萄糖苷酶水解,转化成游离型的苷元从而被机体消化吸收,因此游离型的大豆异黄酮消化吸收率更高[13]。同时其在预防骨质疏松、心血管疾病、神经保护和抗肿瘤等疾病方面有一定的生理功效。并且大豆异黄酮苷元具有较高的市场价格,因此提高豆类食品中苷元类物质的含量,增加大豆异黄酮资源的利用度,对保健食品的开发具有重要意义。
本实验为探究益生菌在全豆乳发酵中对结合态大豆异黄酮的转化,以干酪乳杆菌(Lacticaseibacillus casei)、嗜酸乳杆菌(Lactobacillus acidophilus)、植物乳杆菌(Lactobacillus plantarum)分别发酵全豆乳,以发酵豆乳的pH值降到4.5为发酵终点,测定发酵期间pH值、滴定酸度、活菌数、表观黏度、游离氨基氮和大豆异黄酮含量的变化,并对发酵产品进行感官评价,为益生菌发酵豆乳的研究提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 材料与试剂
干酪乳杆菌(Lacticaseibacillus casei)CICC 23488、植物乳杆菌(Lactobacillus plantarum)CICC 22696,中国工业微生物菌种保藏管理中心;嗜酸乳杆菌(Lactobacillus acidophilus)BNCC 185342,北纳创联生物技术研究院;MRS肉汤、MRS固体培养基,北京奥博星生物技术有限责任公司;乙腈、甲醇和甲酸均为色谱纯,天津市大茂化学试剂厂;大豆苷、大豆苷元、染料木苷和染料木素标准品均为HPLC级,西安晶博生物科技有限公司,含量≧98%。实验所有水均为由Q-Grad®超纯水系统制备的超纯水(18.2 MΩ);其他试剂均为分析纯及以上级别,Sigma-Aldrich。
全豆乳产品,陕西秦豆园农业科技有限公司生产并提供。
1.1.2 仪器设备
HWS智能型恒温恒湿培养箱,宁波江南仪器厂;HaierBCD-206T冰箱,青岛海尔股份有限公司;VisionPlus pH6178 pH剂,安徽赛科环保科技有限公司;YUEJIN超净工作台,苏州安泰空气技术有限公司;SHIMADZU高效液相色谱,岛津企业管理(中国)有限公司;TGL-16 gR高速离心机,上海安亭科学仪器厂;KQ-250DB型数控超声波清洗器,昆山市超声仪器有限公司;BROOKFIELD DV-E型黏度计,上海一恒科技有限公司;立式压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂。
1.2 试验方法
1.2.1 菌株活化与菌悬液制备
将-80 ℃保存的L.casei、L.acidophilus和L.plantarum分别培养在MRS肉汤培养基中,37 ℃,12 h。为了确保益生菌生长活力达到良好的状态,按照活化培养液体积分数为3%的接种量连续传代3次。每次使用前各菌株均在MRS肉汤培养基中活化2代。以上操作均在超净工作台中完成。取10 mL活化培养的种子液制成108 CFU/mL菌悬液。
1.2.2 全豆乳的制作工艺
选料筛选(精选非转基因大豆,颗粒饱满)→浸泡、煮豆→制浆→均质→罐装→杀菌(超高温、短时连续杀菌)→冷却→4 ℃保藏
1.2.3 发酵全豆乳的制备
取300 mL按1.2.2制作的全豆乳平均分装于3个无菌锥形瓶中,按照3%(体积分数,下同)接种量分别将L.casei、L.acidophilus和L.plantarum接种于分装的全豆乳中,用无菌玻璃棒搅拌均匀,37 ℃条件下发酵至终点,将发酵好的全豆乳于4 ℃冷藏备用。
1.2.4 益生菌在全豆乳中的发酵特性及活性物质的含量变化
取300 mL全豆乳平均分装于3个无菌锥形瓶中,以3%接种量分别将L.casei、L.acidophilus和L.plantarum接种于分装的全豆乳中,用无菌玻璃棒搅拌均匀,37 ℃恒温恒湿培养,每隔2 h取样测定其pH值、滴定酸度、表观黏度直至发酵结束(pH 4.5),测定发酵豆乳活菌数、游离氨基氮、大豆异黄酮含量。
1.2.4.1 主要理化指标的测定
水分的测定参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》,以直接干燥法进行测定;灰分的测定参考 GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》,以灼烧重量法进行测定;脂肪含量的测定参考GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》,以索氏抽提法进行测定;蛋白质含量的测定参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》,以凯氏定氮法进行测定。
pH值用pH计在室温下检测;滴定酸度:准确称取发酵全豆乳样品5 g于100 mL锥形瓶中,加入40 mL超纯水,用玻璃棒搅拌均匀,加入2~3滴酚酞指示剂,用0.1 mol/L NaOH溶液滴定至微红色且30 s内颜色不消失。滴定酸度(吉尔涅尔度°T)为100 mL发酵豆乳消耗 0.1 mol/L NaOH的体积(mL)。消耗1 mL 0.1 mol/L NaOH相当于1 °T。
表观黏度使用BROOKFIELD DV-E型黏度计测定发酵全豆乳黏度;游离氨基氮参考CHURCH等[14]的方法,用邻苯二甲醛衍生比色法测定。
1.2.4.2 活菌计数
取一定量的发酵全豆乳,用无菌水进行梯度稀释,然后选取稀释10-5、10-6、10-7倍的发酵全豆乳用平板倾注法测定活菌数。37 ℃倒置培养24~48 h,记录菌落总数,用CFU/mL表示。
1.2.4.3 感官评定
参照文献[15]的方法,邀请从事食品研究的人员男女各5名进行感官评定,每次品尝需在口中细细品味5 s以上并用舌头搅动发酵全豆乳。分别从组织状态、气味、口感和质地打分,每次品尝前需充分漱口,评分标准见表1。
表1 感官评分表
Table 1 Sensory evaluation standard

1.2.4.4 发酵豆乳中大豆异黄酮含量的测定
参照 GB/T 23788—2009《保健食品中大豆异黄酮的测定方法 高效液相色谱法》。
样品预处理:取发酵豆乳5 mL于50 mL容量瓶,加入80%(体积分数,下同)甲醇溶液至接近刻度线,然后以100 W功率超声振荡40 min。超声结束后用80%甲醇定容,摇匀。取适量样品溶液以8 160 r/min离心15 min。将上清液过0.45 μm滤膜后备用。
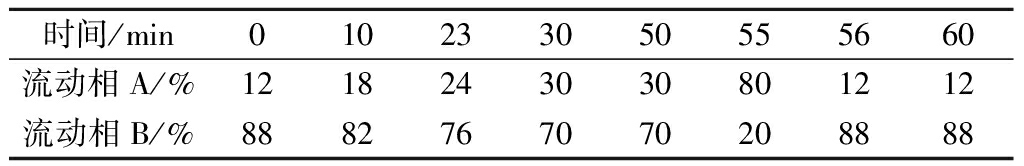
HPLC色谱条件:色谱柱:ZORBAXSB-C18色谱柱(4.6 mm×250 mm,5 μm);流动相A:乙腈;流动相B:0.5%甲酸超纯水。流速1 mL/min;波长260 nm;进样量20 μL;柱温30 ℃。梯度洗脱程序见表2。
表2 梯度洗脱程序
Table 2 Gradient elution procedures
1.2.5 数据分析
所有实验至少重复3次,结果以“平均值±SD”表示。采用SPSS 15.0软件对实验数据进行统计学分析,Origin 7.0软件绘图。文中上标字母不同表示存在显著性差异(P<0.05)。
2 结果与分析
2.1 全豆乳主要理化指标的测定结果
本实验制备的全豆乳水分含量为81.49%,灰分、脂肪和蛋白质含量分别为1.15%、2.78%和4.35%。
2.2 三株益生菌对全豆乳的发酵特性
2.2.1 全豆乳发酵过程中pH值的变化
分别以L.casei、L.acidophilus和L.plantarum发酵全豆乳,每隔2 h测定发酵期间的pH值至发酵终点,结果如图1所示。

图1 三株益生菌发酵全豆乳pH值的变化
Fig.1 Changes in pH value of whole soymilk fermented by three probiotics
L.casei和L.plantarum发酵全豆乳pH值下降的速度较快,而L.acidophilus发酵全豆乳在0~7 h时pH值下降缓慢,7~14 h时呈快速下降趋势。其中,L.casei发酵全豆乳到达终点(pH 4.5)用时最短,为7 h;而L.acidophilus发酵全豆乳到达终点用时最长,为20 h,这可能是由于其蛋白水解能力较弱造成的。CHURCH等[14]用单一益生菌发酵豆乳,结果显示达到发酵终点用时较长,与本研究所得结论基本一致。
2.2.2 全豆乳发酵过程中滴定酸度值的变化
由图2可知,L.acidophilus发酵全豆乳在0~6 h时滴定酸度值变化缓慢,然后呈现快速上升趋势。L.plantarum发酵全豆乳在发酵结束时滴定酸度值最高,为66.17 °T,与L.acidophilus发酵全豆乳滴定酸度值没有显著差异。而L.casei发酵全豆乳在发酵结束时滴定酸度值显著低于其他益生菌发酵的样品(P<0.05),为32.83 °T。
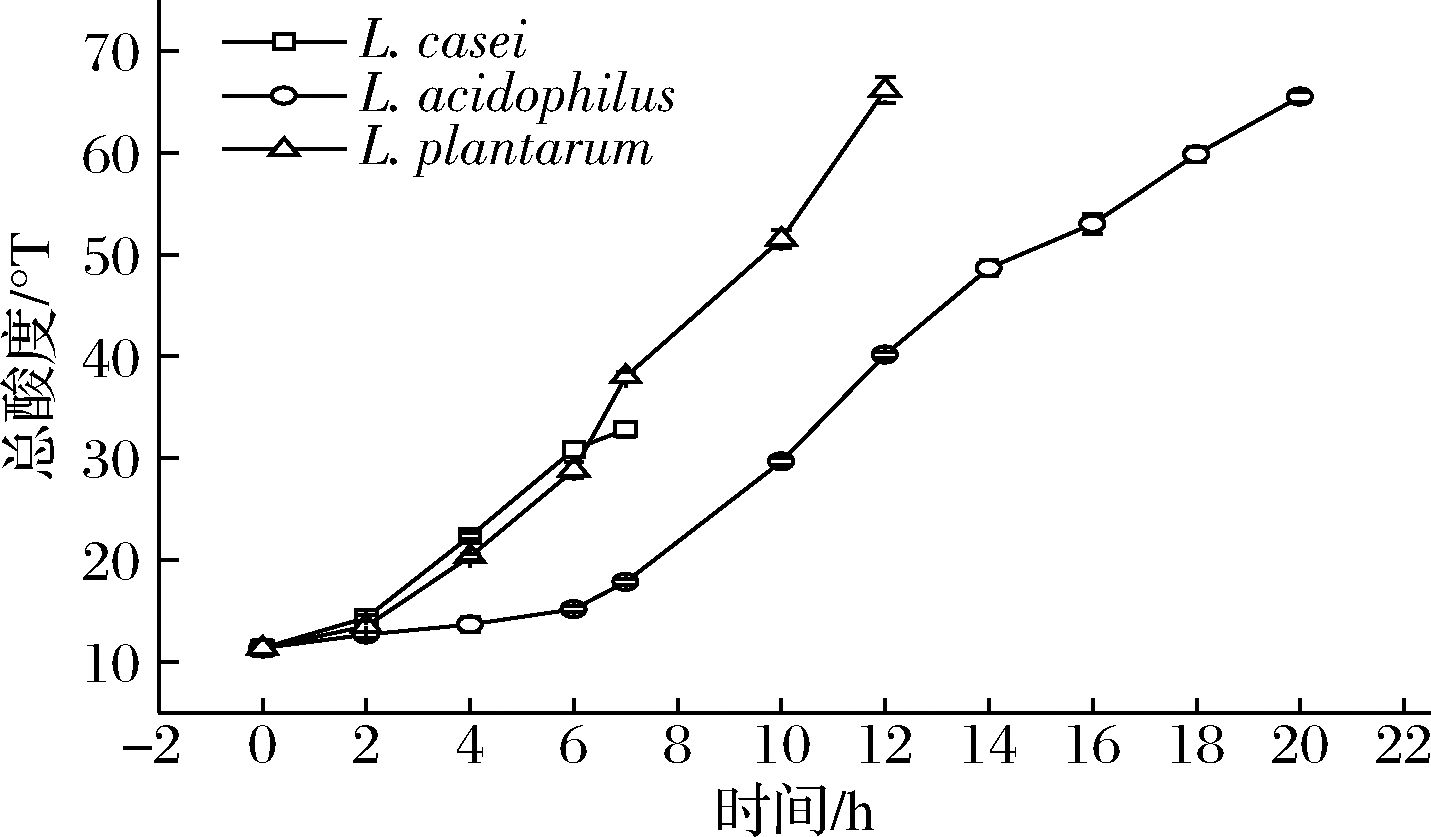
图2 三株益生菌发酵全豆乳滴定酸度值的变化
Fig.2 Changes in titration acidity of whole soymilk fermented by three probiotics
2.2.3 全豆乳发酵过程中表观黏度的变化
分别以L.casei、L.acidophilus和L.plantarum发酵全豆乳,每隔2 h测定发酵期间的黏度值至发酵终点,结果如图3所示。
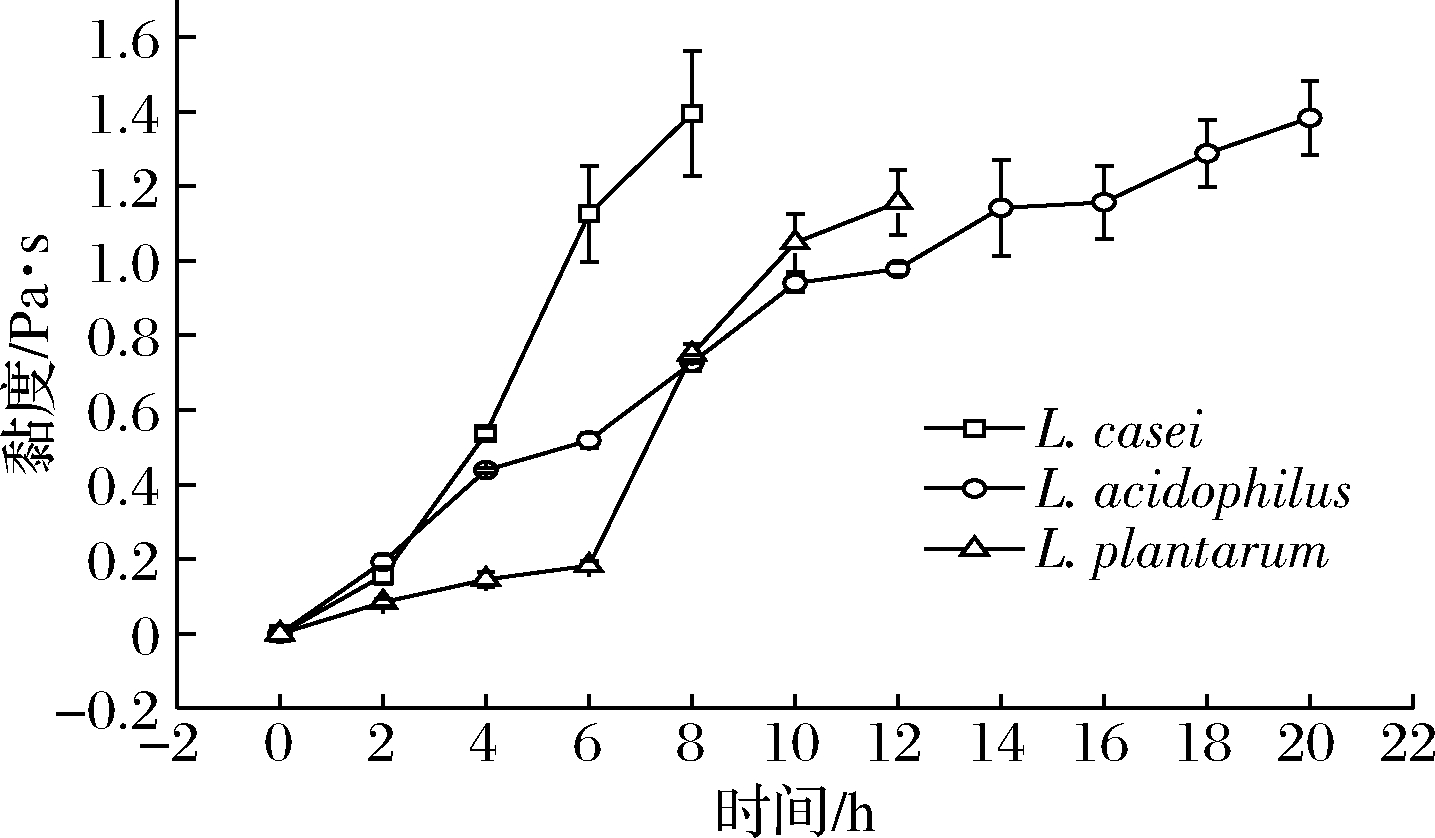
图3 三株益生菌发酵全豆乳黏度的变化
Fig.3 Changes in viscosity of whole soymilk fermented by three probiotics
3株益生菌发酵全豆乳黏度呈现快速上升趋势,发酵结束时均在1.0~1.4 Pa·s,其中L.casei发酵全豆乳黏度略微高于其他益生菌,为1.397 Pa·s。L.casei发酵全豆乳表观黏度在短时间内快速上升,这可能是由于益生菌的快速增殖使得乳酸含量升高,大豆蛋白凝固形成酸凝胶,导致黏度迅速增加[16]。其他2种菌发酵全豆乳的表观黏度变化比较平缓,这与它们较长的发酵时间相吻合,表明这2种菌增殖速度相对较慢,相应的乳酸含量增加也较慢,表观黏度也因此呈现平缓上升的趋势。
2.2.4 全豆乳发酵起始和结束时的活菌数
发酵乳制品中活菌数须在106 CFU/mL以上且能在肠道中存活才能发挥其益生特性[17]。由表3可知,发酵结束时,3株益生菌发酵全豆乳活菌数均显著升高(P<0.05),均>108 CFU/mL。其中,L.casei发酵全豆乳到达发酵终点时活菌数最高为2.03×109 CFU/mL。这可能是因为发酵过程中会产生一些碳源如水苏糖、棉子糖、蔗糖、葡萄糖等,这些物质可作为发酵菌的能量来源,加速了发酵菌的生长增殖。
表3 发酵起始和结束时的活菌数 单位:lg CFU/mL
Table 3 Number of viable bacteria at the beginning and the end of fermentation
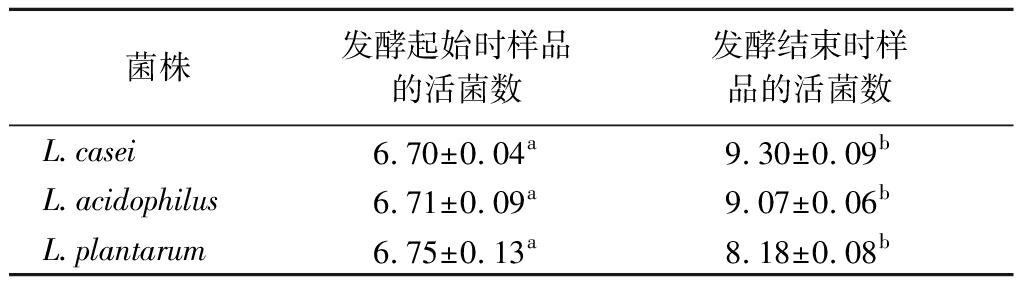
注:同行中不同字母表示差异显著(P<0.05)
2.2.5 全豆乳发酵过程中游离氨基氮的变化
分别以L.casei、L.acidophilus和L.plantarum发酵全豆乳,测定发酵结束时的游离氨基氮的含量,结果如图4所示。发酵结束时,L.acidophilus的蛋白质水解能力最强,其发酵结束时游离氨基氮的含量为3.09 mmol/L。而L.casei的蛋白质水解能力较其他2株菌弱,发酵结束时游离氨基氮的含量为2.39 mmol/L。其可能原因是发酵时间越长,全豆乳中大豆蛋白水解越彻底。菌株的类型和发酵时间可能影响蛋白水解的活性[18]。此结论与本研究结果基本一致。
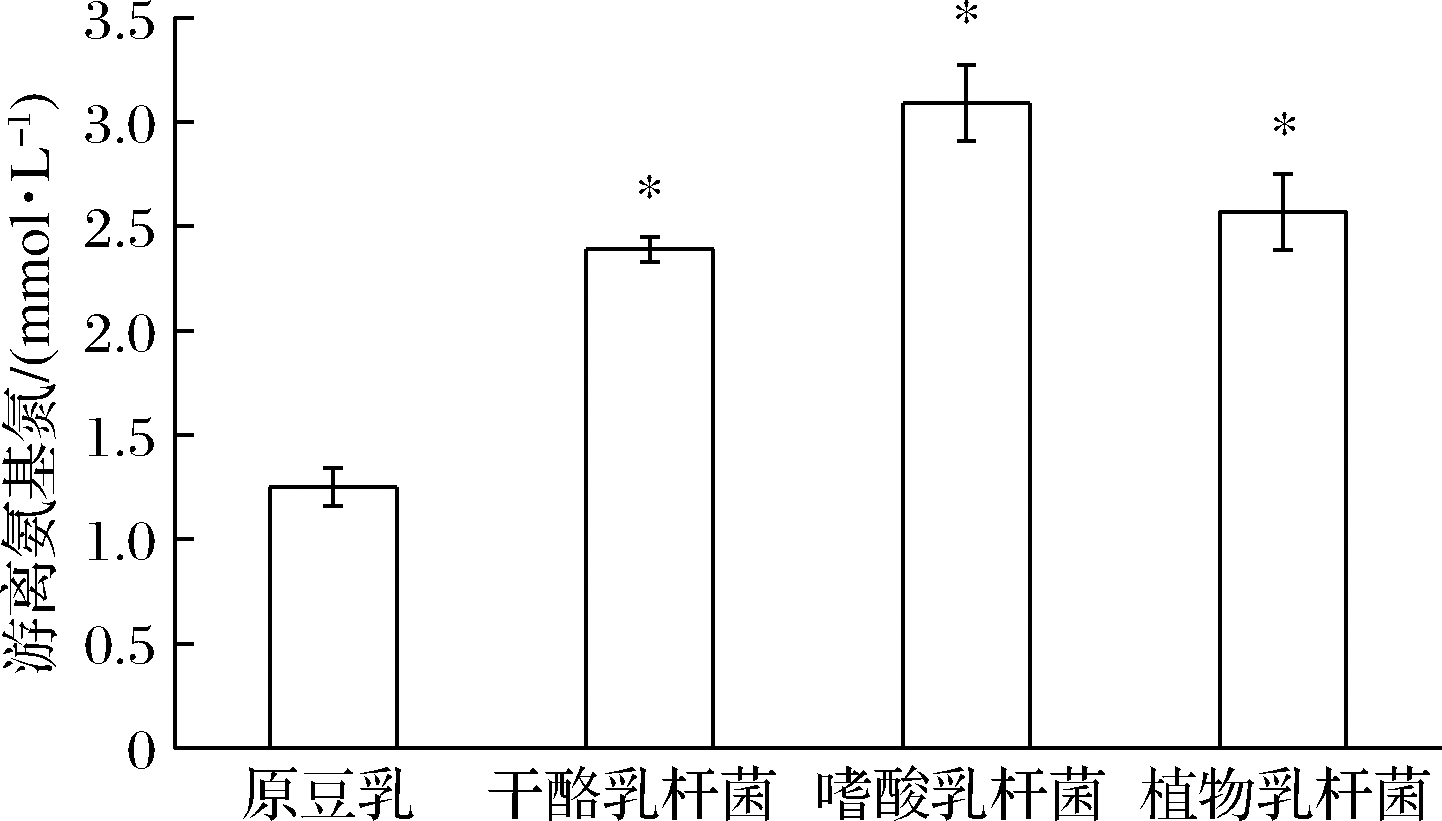
图4 三株益生菌发酵全豆乳游离氨基氮的变化
Fig.4 Changes of free amino nitrogen in whole soymilk fermented by three probiotics
2.2.6 感官评定
图5为发酵结束后于4 ℃冰箱贮藏12 h后全豆乳的感官评价结果。由图5可知,L.casei发酵全豆乳感官评分最高,L.plantarum次之,L.acidophilus最低。L.casei发酵全豆乳具有外观光滑紧致、色泽柔和、产品形状保持较好的特点。虽有少量乳清析出,但酸甜比例适宜、口感细腻、无豆腥味、味道可口,符合大众口味。因此,L.casei更适合发酵有良好口感的豆乳,开发出畅销大众的新产品。
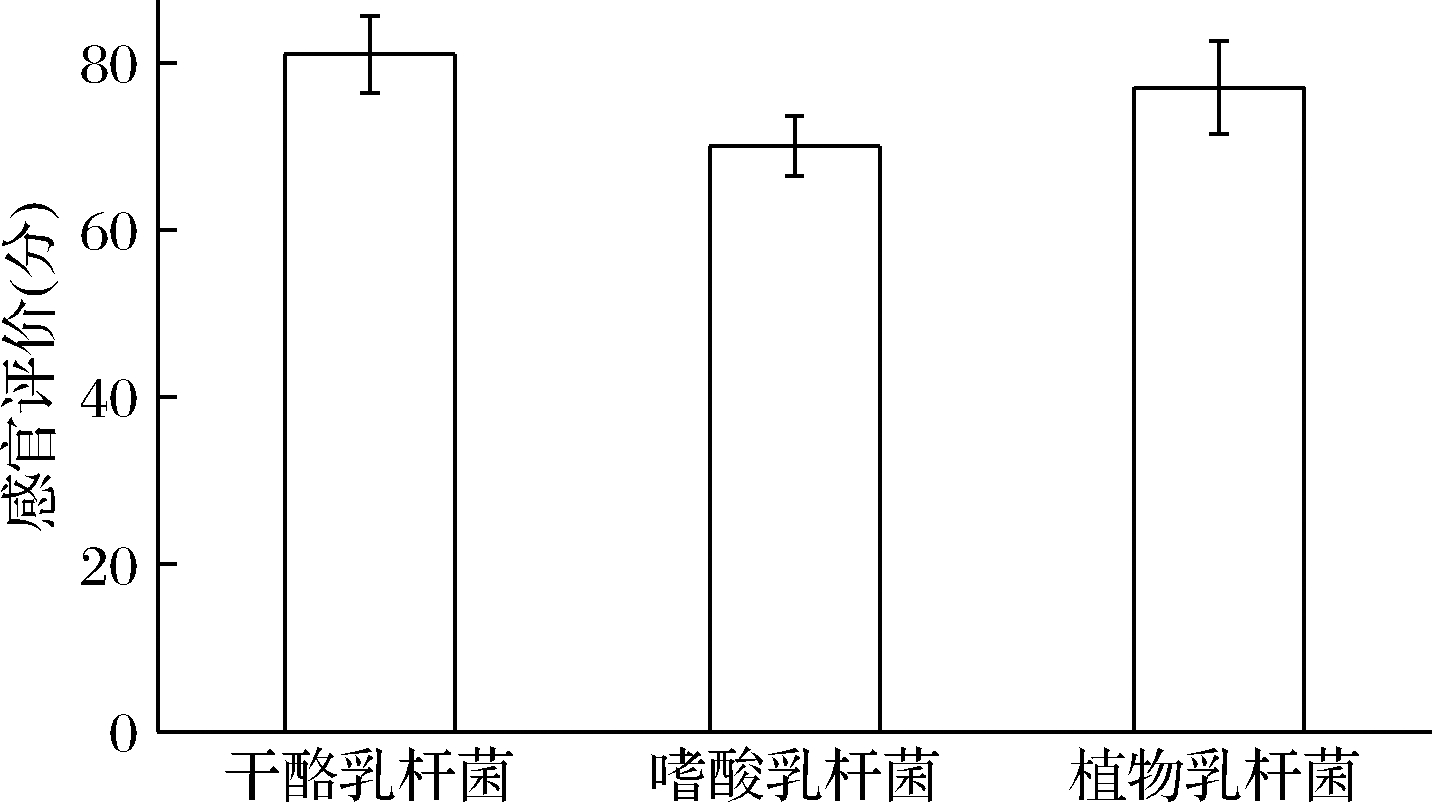
图5 三株益生菌发酵全豆乳感官评分
Fig.5 Sensory scores of whole soymilk fermented by three probiotics
2.3 三株益生菌发酵全豆乳中大豆异黄酮的含量
2.3.1 原全豆乳中大豆异黄酮含量的测定
大豆异黄酮类物质中主要包括大豆苷、染料木苷、大豆苷元和染料木素等活性成分。通过益生菌发酵将大豆中糖苷形式的大豆异黄酮转化为苷元形式的大豆异黄酮,可极大增加其消化吸收率。
如图6所示,原全豆乳主要含大豆苷和染料木苷,含量分别为67.30、104.6 μg/mL,苷元和染料木素的含量较少,分别为3.13、2.43 μg/mL。这与大豆异黄酮中,苷元占2%~3%,糖苷占97%~98%的结果一致[12]。
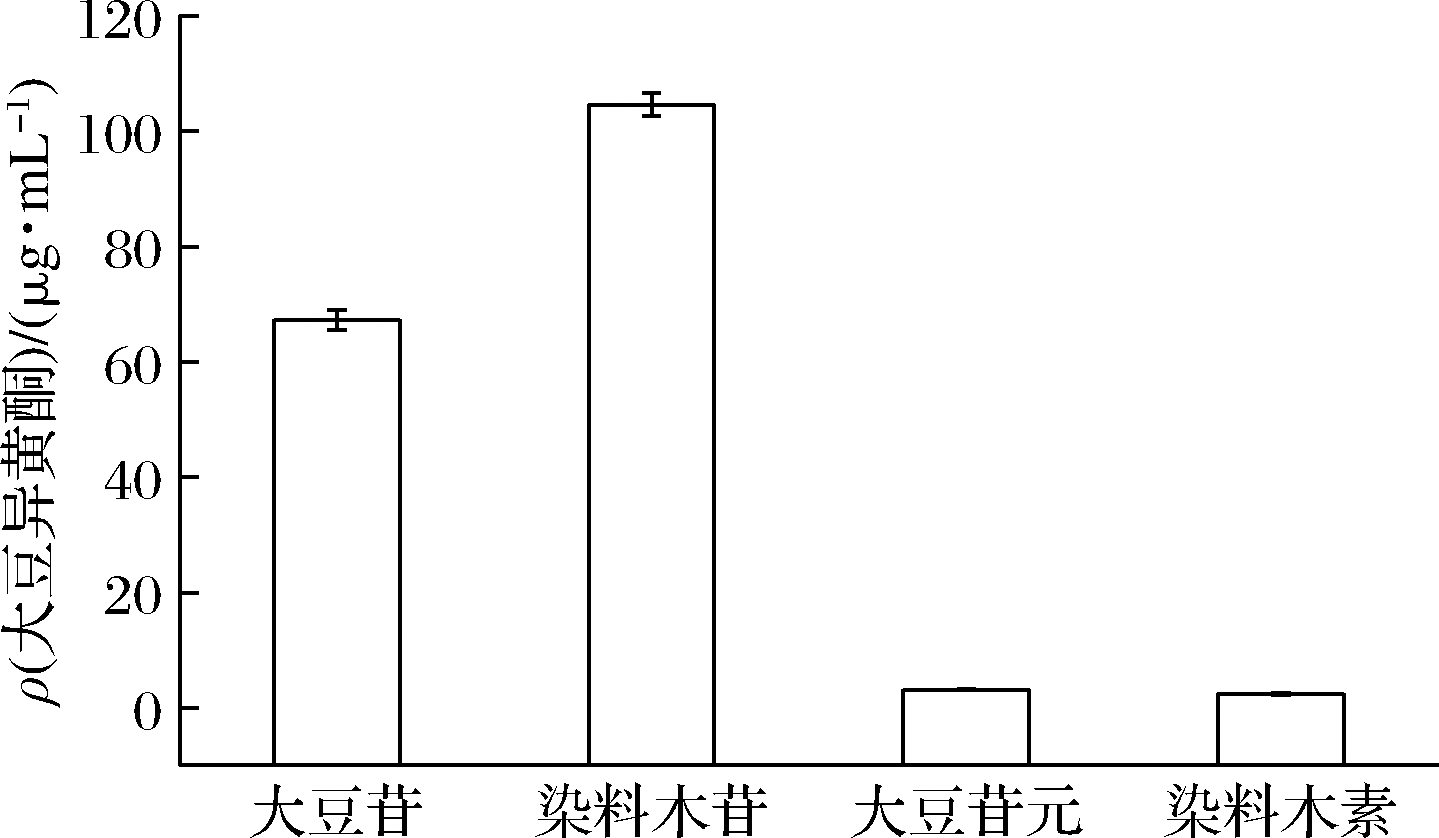
图6 原全豆乳中大豆异黄酮含量
Fig.6 Soy isoflavone content in original whole soymilk
2.3.2 大豆苷和大豆苷元在全豆乳发酵期间的变化
由图7-a可知,L.casei和L.acidophilus发酵全豆乳中大豆苷含量在发酵结束时显著下降(P<0.05),L.plantarum发酵全豆乳中大豆苷含量在发酵前后没有显著差异(P>0.05)。而图7-b显示3株益生菌发酵全豆乳中大豆苷元含量在发酵前后均显著上升(P<0.05)。其中,L.casei发酵全豆乳中大豆苷元含量为6.23 μg/mL,是原全豆乳的2.0倍;L.acidophilus发酵全豆乳中大豆苷元含量为5.73 μg/mL,是原全豆乳的1.8倍;L.plantarum发酵全豆乳中大豆苷元含量最高,为9.59 μg/mL,是原全豆乳的3.1倍。说明L.plantarum能够很好地分解糖苷型大豆苷,生成游离型的大豆苷元。
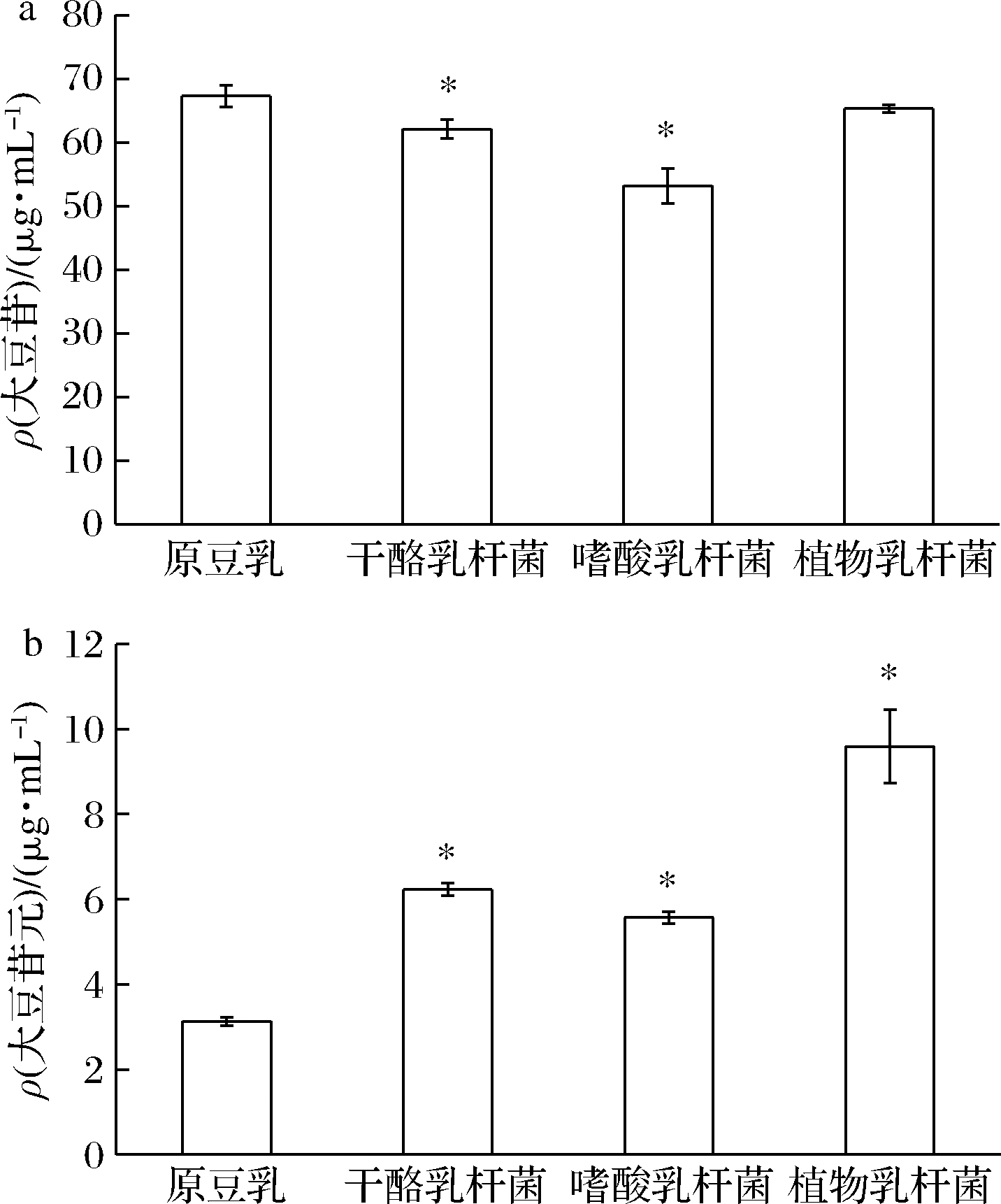
a-大豆苷含量;b-大豆苷元含量
图7 三株益生菌发酵全豆乳大豆苷和大豆苷元的变化
Fig.7 Changes of daidzin and daidzein of whole soymilk fermented by three probiotics
2.3.3 染料木苷和染料木素在全豆乳发酵期的变化
由图8-a可知,3株益生菌发酵全豆乳中染料木苷含量在发酵结束时均有下降,其中L.acidophilus发酵全豆乳中染料木苷含量下降最明显,下降了13.1%。而图8-b显示,3株益生菌发酵全豆乳中染料木素的含量经发酵后显著上升(P<0.05),其含量分别增加到12.97、8.57、18.73 μg/mL,分别是原全豆乳的5.3、3.5、7.7倍。其中,L.plantarum发酵全豆乳中染料木素含量最高。这与发酵过程苷类物质水解为对应苷元物质的结论一致[19]。
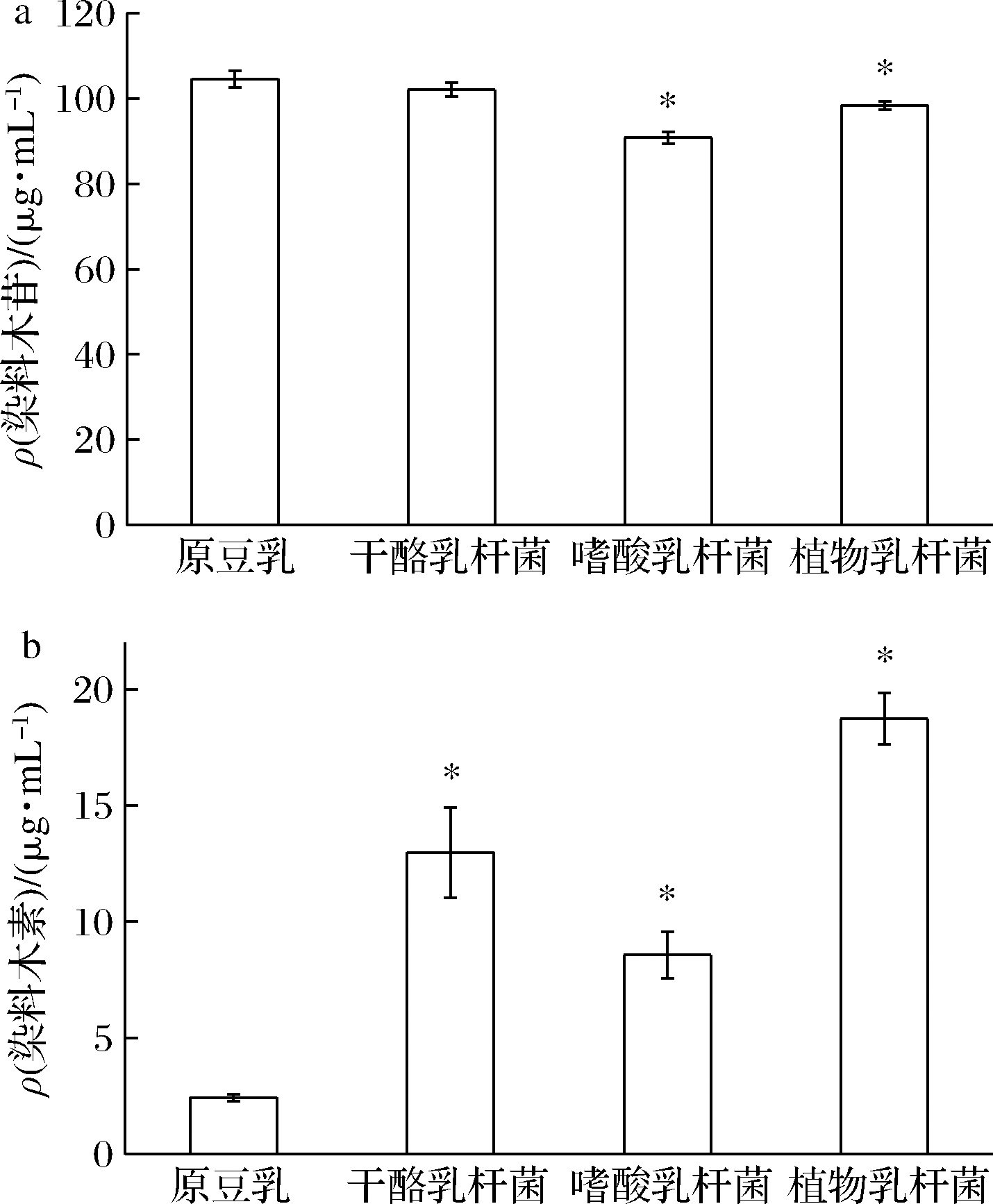
a-染料木苷含量;b-染料木素含量
图8 三株益生菌发酵全豆乳染料木苷和染料木素的变化
Fig.8 Changes of genistein and genistein of whole soymilk fermented by three probiotics
3 结论
本研究以L.casei、L.acidophilus和L.plantarum分别发酵全豆乳,以pH值降到4.5为发酵终点。发酵期间,3株益生菌发酵全豆乳pH值显著下降,而滴定酸度和表观黏度均显著升高(P<0.05)。L.acidophilus发酵全豆豆乳到发酵终点用时最长,为20 h,大豆蛋白水解彻底,所以游离氨基氮含量最高,为3.09 mmol/L。发酵结束时,3株益生菌发酵全豆豆乳的活菌数均>108 CFU/mL。
L.casei发酵全豆乳具有外观光滑紧致、色泽柔和、产品形状保持较好的特点。虽有少量乳清析出,但酸甜比例适宜,无豆腥味,味道可口,符合大众口味,适合用于发酵出具有良好口感的豆乳。
发酵全豆乳大豆苷元、染料木素含量较原全豆乳中有显著升高(P<0.05)。其中,L.plantarum发酵全豆豆乳中大豆苷元和染料木素含量最高,为9.59、18.73 μg/mL,分别是原全豆乳的3.1、7.7倍。因此L.plantarum发酵豆乳可显著提高结合态大豆异黄酮的转化效率,提高了游离态大豆异黄酮的含量,从而增加人体对大豆异黄酮的消化吸收率,具有更高的营养保健价值。
- 我用了一个很复杂的图,帮你们解释下“23版最新北大核心目录有效期问题”。
- 重磅!CSSCI来源期刊(2023-2024版)最新期刊目录看点分析!全网首发!
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?
- 《农业经济》论文投稿解析,难度指数四颗星,附好发选题!
- 期刊知识:学位论文完成后是否可以拆分成期刊论文发表?
- 号外!出书的人注意啦:近期专著书号有空缺!!

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



