食用黄花菜SSR标记开发及指纹图谱库构建
黄花菜俗称“金针菜”,在植物分类学上属百合科萱草属(Hemerocaliss L.)植物[1],是一种药食同源的特色蔬菜,其花蕾可食用,具有丰富的营养价值,与香菇、木耳、冬笋并称为“四大素山珍”[2]。据报道,黄花菜的挥发性成分多达58种[3-4],含有大量的醇、酯等香气物质,赋予黄花菜特有的美味。近年来有研究表明,食用黄花菜还有抗氧化、抑制纤维原细胞增生及阻止癌细胞生殖等作用[5]。
随着分子生物学的发展,DNA 分子标记鉴定因快速准确、不受环境影响等优点逐渐发挥重要作用,满足品种快速准确鉴定和指纹图谱构建的要求[6-7]。其中SSR标记具有共显性、高度重复性和丰富的多态性等优点,通过PCR快速检测就能达到鉴定目的。目前基于SSR分子标记的玉米、大豆、小麦、油菜等主要农作物的指纹图谱库已构建完成[7-11]。关于黄花菜品种DNA指纹图谱及分子标识研究,陈士林院士[12]针对药用黄花菜开展过DNA条形码分子鉴定研究。
在农业科技迅速发展和农产品市场竞争日趋剧烈的今天,真正的特色农产品优势发挥离不开现代农业技术。食用黄花菜作为特色加工型农产品,利用现代农业技术快速发展优良种质、产地标识及分子身份证构建研究已迫在眉睫。本研究拟利用转录组测序技术开发黄花菜的SSR标记,构建黄花菜DNA指纹图谱库,预期研究结果为食用黄花菜种质资源鉴定、评价及遗传多样性分析提供技术,进一步为品种更新及产业扶贫提供科技支撑。
1 材料与方法
1.1 实验材料
供试43份食用黄花菜种质资源由甘肃省农科院黄花菜种质资源圃提供,种质名称及来源见表1。
1.2 实验方法
1.2.1 EST-SSR引物设计与筛选
采用二代测序技术对黄花菜进行转录组测序,并使用MISA软件对所有测序所得的转录本进行SSR位点搜索。搜索标准为:SSR重复最低长度为18 bp,单核苷酸、二核苷酸、三核苷酸、四核苷酸、五核苷酸和六核苷酸重复最低次数为12、6、5、5、4和4次,间隔不完全重复的SSR位点不列为搜索对象。结合SSR位点两端保守的特点,利用Primer 3.0软件进行批量引物设计,共设计引物11 363对,根据基因注释分类,挑选出氨基酸代谢和萜类聚酮化合物代谢相关的Unigene中的SSR引物进行合成,共计89对。另从文献中搜索得到25对萱草属通用的SSR引物[13-14],合计114对引物进行筛选鉴定。
表1 黄花菜种质名称及来源
Table 1 The names and original of Hemerocallis citrina

引物设计的原则为EST序列长度大于200 bp,SSR序列的开始和结束位置分别距5’和3’端不少于20 bp,引物长度18~24 bp,退火温度Tm值40~60 ℃,上游和下游引物的Tm值相差不大于5 ℃,GC含量40%~60%,且上游和下游引物的GC含量相差不要太大,产物预期长度100~500 bp。对各条引物的最佳退火温度进行试验,以每条引物的解链温度(Tm值)为参考,上下各浮动5 ℃,通过梯度PCR仪自动生成8个温度梯度,以扩增条带多且明亮、背景清晰者为最适温度选择。
1.2.2 样品DNA提取
样品由硅胶颗粒迅速干燥后带回,每个样品取约50 mg,球磨仪研磨后用天根的植物基因组DNA提取试剂盒进行样品DNA的提取,提取完成后用1%的琼脂糖凝胶电泳进行样品DNA质量的检测,并用超微量分光光度计测定其浓度和纯度,将DNA稀释至20~50 ng/μL,4 ℃保存备用。
1.2.3 PCR扩增
PCR扩增体系总反应体积15 μL,包括2×Taq Master Mix 7.5 μL,DNase-Free Water 4.5 μL,Forward Primer 1 μL,Reverse Primer 1 μL,模板DNA 1 μL。反应程序:95 ℃热启动3 min,95 ℃变性45 s,48~65 ℃ 退火30 s,72 ℃延伸1 min,30个循环后,72 ℃终延伸5 min后结束。
1.2.4 非变性聚丙烯酰氨凝胶电泳与生物分析仪检测
利用1.5%的琼脂糖凝胶和6%的非变性聚丙烯酰胺凝胶进行引物的初筛和多态性筛选,待筛选出核心引物后,使用核心引物对所有供试材料进行PCR扩增,扩增产物稀释10倍后上样至LabChipGx Touch大分子生物分析仪进行自动化检测,软件自动收集电泳数据。
1.2.5 数据分析
利用Excel软件统计分析数据,NTSYS软件的UPGMA进行聚类分析。利用 PIC(polymorphism information content)评价引物多态性,PIC计算如公式(1)所示:
(1)
式中:Pij表示标记i的第j个等位基因在群体中的频率[15]。
2 结果与分析
2.1 黄花菜转录组SSR位点分布频率与基序特征
采用Illumina Hiseq技术,从黄花菜样品中测序共得到104 177个Unigene,总长度为79 106 833 bp, 平均长度为759 bp,GC含量为41.99%。利用MISA软件对Unigene进行搜索,共检测到15 890个SSR,分布于12 492个Unigene,占总序列的11.99%,含有2个或2个以上SSR的Unigene有2 545个,复合SSR有1 316个,占总序列的8.28%。从黄花菜EST-SSR中基元分布频率情况(表2)看,单核苷酸到六核苷酸基元类型均有分布,其中三核苷酸重复占比最高,为44.26%,二核苷酸和单核苷酸次之,分别为27.23%和18.57%,四、五、六核苷酸占比较低,不足5%。从重复次数看, 黄花菜转录组SSR重复基序的重复次数分布在4~115次, 其中4~8次的SSR个数占总数的69.93%;其次为9~12次的SSR, 共有2 095个, 占总数的13.18%;13次以上重复的有 2 699个,占16.99%(表2)。其中,单核苷酸重复次数以≥13次为主,占单核苷酸总重复次数的76.37%,二核苷酸重复次数主要以6~7次重复为主,占二核苷酸总重复次数的53.78%,三核苷酸重复中以5~6次重复为主,占三核苷酸总重复次数的72.64%。
从黄花菜基元类型分布图(图1)看,单核苷酸重复基元类型以(A/T)n为主,占单核苷酸重复总数的96.387%;二核苷酸重复基元类型以(AG/CT)n和(AT/AT)n为主,分别占比64.16%和26.25%;三核苷酸重复基元类型以(AAG/CTT)n和(AGG/CTT)n较多,占比分别为26.87%和15.23%,其余还有8种基元类型,占比从2.55%到10.93%均有分布;四、五、六核苷酸重复基元类型以(AAAT/ATTT)n、(AAAAT/ATTTT)n和(AACCCT/AGGGTT)n最多。
表2 黄花菜EST-SSR的分布频率
Table 2 The distribution of the SSR motifs in Hemerocalli scitrina
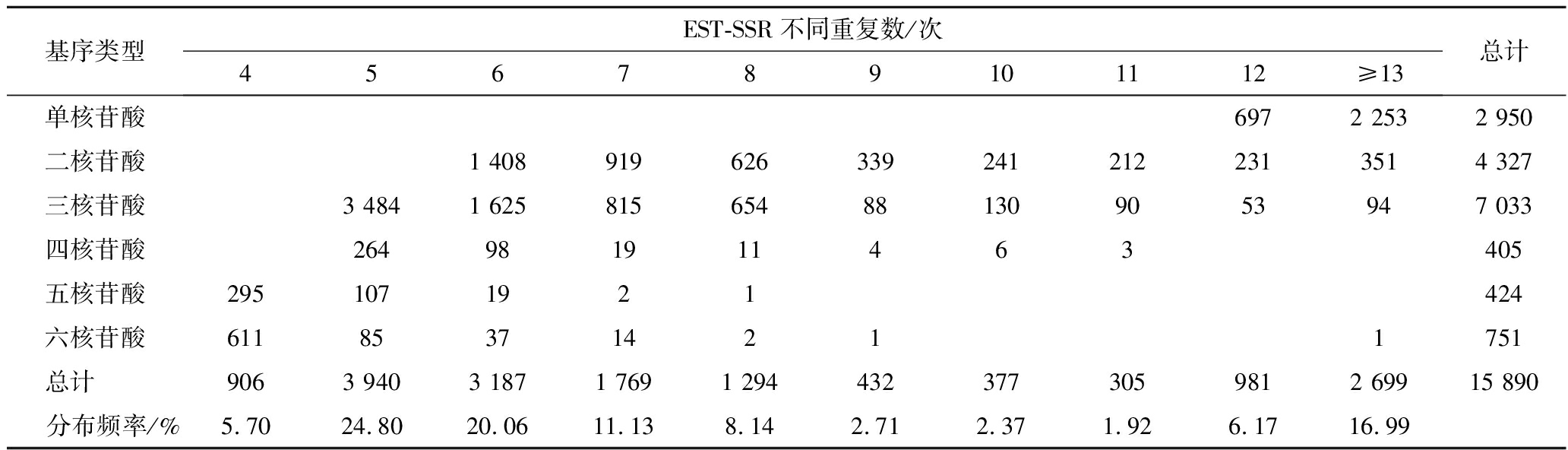
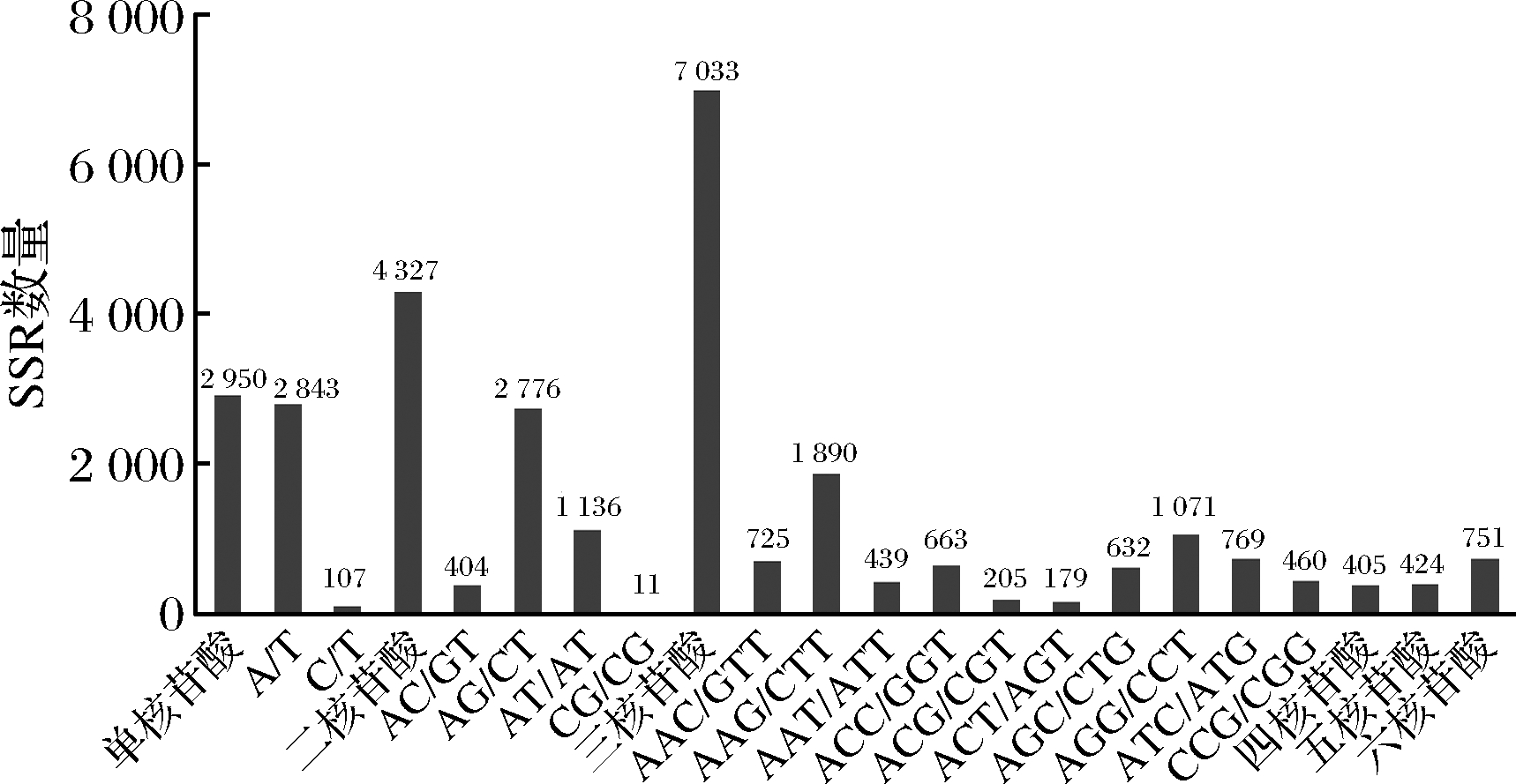
图1 黄花菜EST-SSR基元类型分布
Fig.1 The distribution of EST-SSR types in Hemerocallis citrina
2.2 EST-SSR核心引物筛选及多态性分析
以2份黄花菜种质(祁东白花菜和金蕾1号)为材料,采用PCR扩增琼脂糖凝胶电泳检测,对114对SSR引物进行初步筛选,共选出扩增条带清晰、目标条带大小相一致的引物70对,有效引物比率为60.87%;选择6份不同地方来源的黄花菜作为材料,利用6%非变性聚丙烯酰氨凝胶电泳对70对初选引物进行多态性引物筛选,共筛选出条带清晰、多态性高、扩增稳定的引物33对,多态性引物扩增率为26.09%;进一步选用供试43份黄花菜种质材料,对上述筛选出的33对引物进行PCR扩增、6%非变性聚丙烯酰胺凝胶电泳检测,最终筛选出20对品种类型间多态性高、条带清晰易读取的SSR引物作为黄花菜指纹图谱构建的核心引物(表3)。20对引物中二核苷酸重复4对,三核苷酸重复13对,四、五、六核苷酸重复各占1对,重复次数主要以5~6次为主。
20对核心引物的PIC值变幅为0.23~0.77,平均为0.499 5。其中,引物HH42的PIC值最高,HH78的PIC值最低。20对核心引物中有12对引物为高度多态位点(PIC>0.50),占比60%,7对引物为中度多态位点(0.25≤PIC≤0.50),占比35%,1对引物为低度多态位点(PIC<0.25),占比5%,表明筛选出的20对核心引物在参试品种间具有丰富的多态性。
2.3 指纹图谱库的构建
20对核心引物对43份黄花菜种质进行扩增检测,统计各黄花菜种质在20个SSR位点上的扩增片段大小,用片段大小命名各等位变异,建立包含43份黄花菜种质的DNA指纹图谱库(表4),筛选出安民花1号、祁东四月花、棒槌花、高箭中期花、雪不谢苗、祁东中期花、四川武平旱共7个黄花菜品种的特异标记。在20个位点中共检测到88个等位变异,每个位点的等位变异数为3~8个,平均为4.4个。
2.4 聚类分析
根据NTSYS软件genemic similiarity计算,43份黄花菜种质材料间的遗传距离变化为0~0.813 8,遗传相似度变化范围为0.443 2~1,从聚类图(图2)中看出,其中有5组(I-V)材料,每组材料间相似度为1,组内无法区分,分别是:I组为渠县花、山西大同花、未知2和未知4;II组为淮阳花、沙苑金针和浙江仙居花;III组为祁珍花和未知黄花型;IV组为猛子花、沐阳采集种质和金蕾1号;V组为重庆红花和龙游红花菜。除去以上14种种质资源,剩余的29份种质均可以进行区分,且以上5组材料组间仍然可以进行区分。
表3 20对EST-SSR引物信息
Table 3 The primer information for 20 pairs of EST-SSR
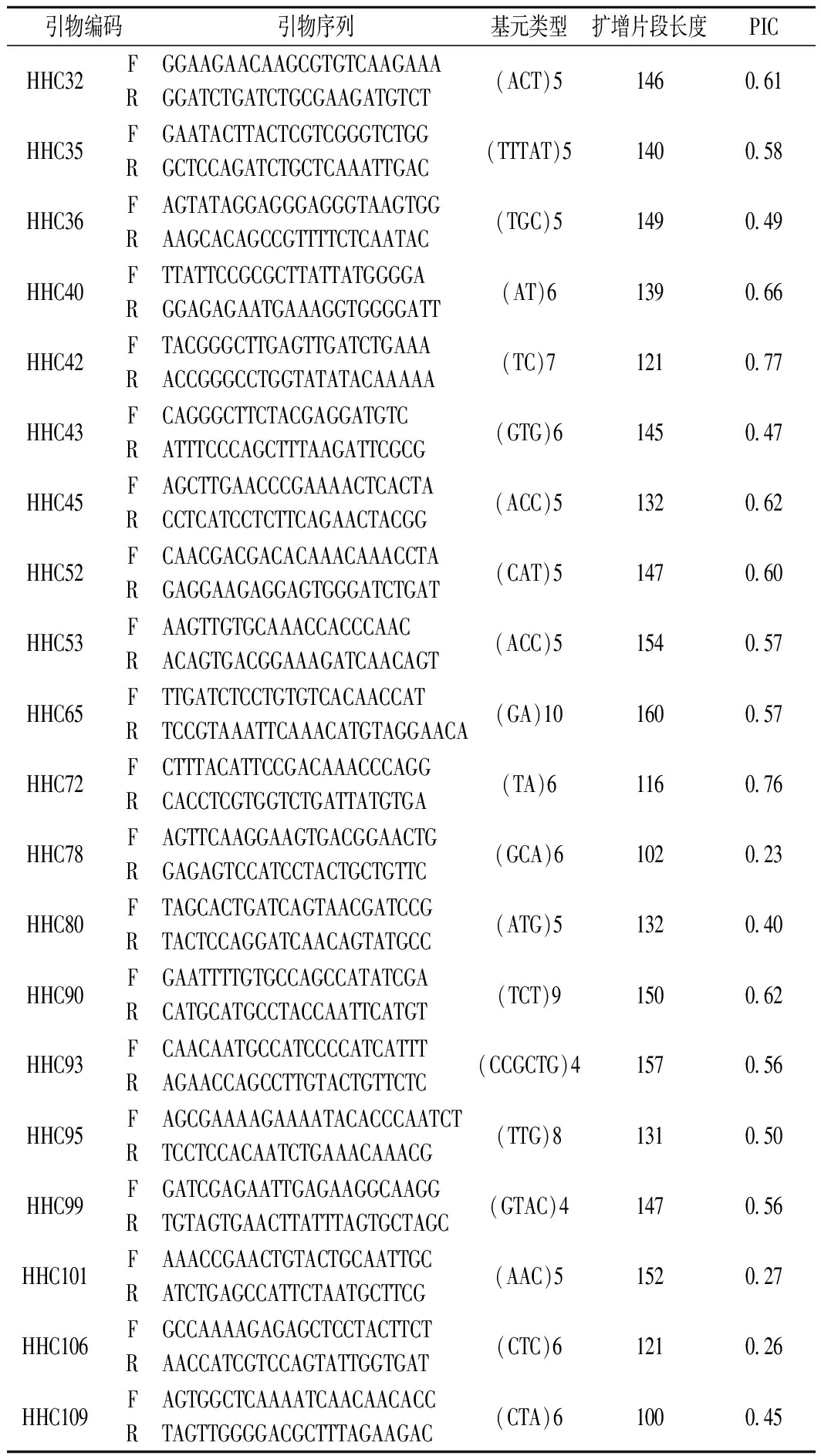
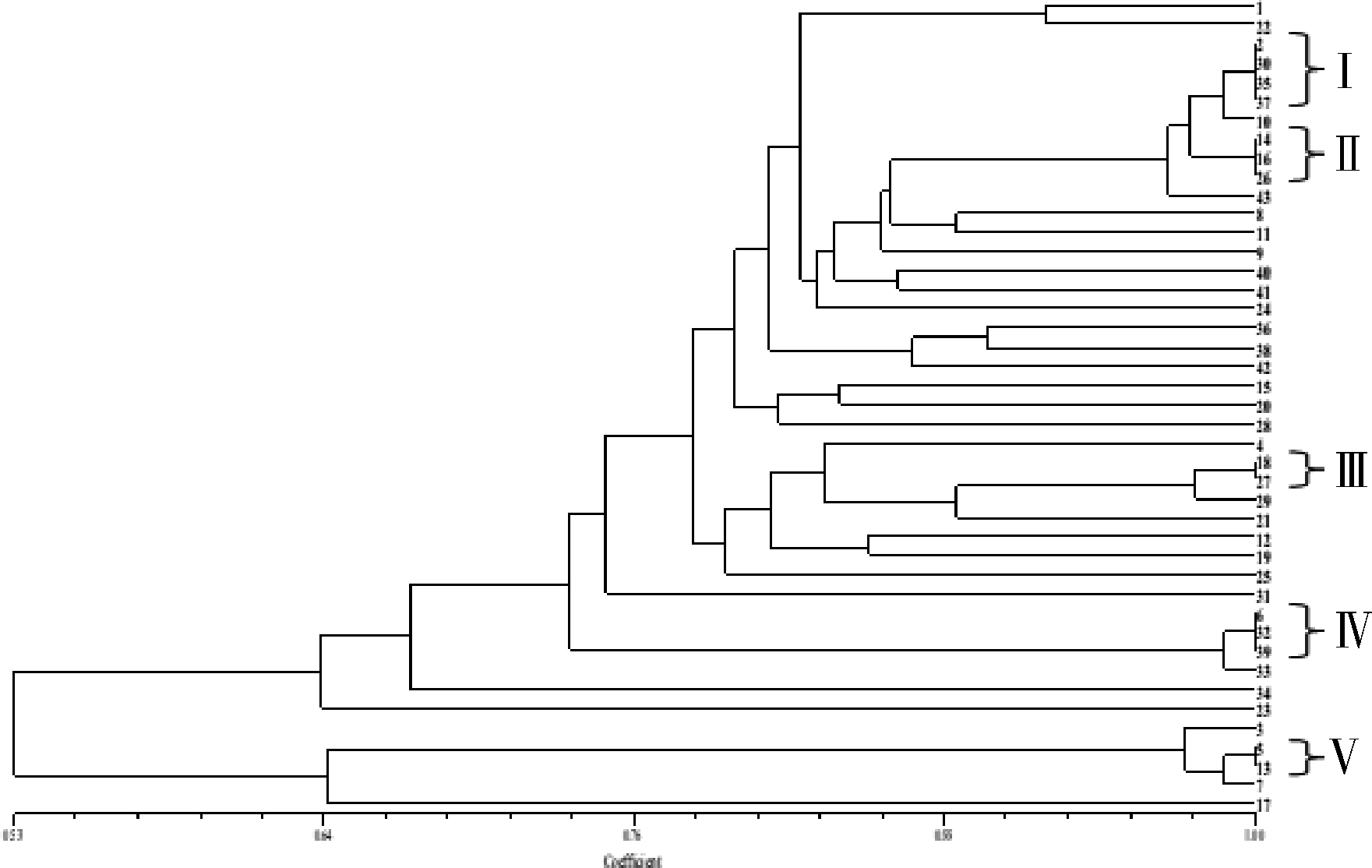
图2 43份黄花菜种质聚类图
Fig.2 The cluster analysis dendrogram of 43 varietiesin in Hemerocallis citrine
3 讨论
种质资源是植物遗传改良的物质基础,然而,日益庞大的种质数量增加了资源收集保存和遗传改良工作量,导致工作效率低下[15]。通过分子标记鉴定,筛选淘汰同名异物、同物异名的冗余种质,提高种质资源的鉴定保存效率。与其他分子标记相比,SSR 分子标记在基因组上分布均匀、数量丰富、稳定性好且技术成熟,可从DNA水平直接鉴定品种间遗传差异[16]。国际植物新品种保护联盟把SSR和SNP作为作物品种DNA 指纹库构建的分子标记[17],并已经在遗传多样性分析、品种鉴定、群体结构及图谱构建等方面得到应用[18-20]。李益等[21]利用21对SSR核心引物,构建了包含500份柑橘品种的 DNA 指纹图谱库,筛选出部分品种的特异标记,可以鉴别221份柑橘品种和87个品种组合。分子标记在黄花菜上的应用十分滞后,主要有以下几方面的进展:郑家祯等[22]利用SCoT分子标记技术对28份国内栽培的黄花菜资源19个形态学特征进行了遗传多样性分析,李森等[23]对85份萱草属植物开花表型性状进行多样性分析,黎海利等[24]借助 AFLP标记对35份萱草野生种和栽培品种进行亲缘关系研究,但是这些研究很少结合形态学和分子标记进行比对分析,且未专门针对国内食用黄花菜的品种资源进行分析。
本研究所选的20对核心引物能将43份地方种质中的29份有效区分,未能区分开的品种有5组共14个。通过分析14个品种的亲本、植物学性状、来源等相关信息发现,这些品种的特征特性较为接近,例如“重庆红花菜”和“龙游红花菜”这一组,2个品种在开花期花朵颜色、大小、叶形等植物学性状完全相同。“渠县花、山西大同花、未知2和未知4”这组可能存在同一个品种在不同地方因品种名称不一样而被重复收集的情况,也就是同种异名的现象。由于黄花菜育苗仍以农民自己传统育种为主,有些品种可能是在地方品种的基础上提纯复壮而来,两者间的遗传背景一致,因此利用有限数量的分子标记仍难以鉴别。
4 结论
本研究筛选出20对扩增稳定、条带清晰、多态性高的核心引物,依据扩增产物的片段大小确定了每个SSR位点的等位变异以及对应的参照品种,建立了基于EST-SSR的DNA指纹鉴定技术体系,并构建了43份黄花菜种质的DNA指纹数据,可以应用于黄花菜种质鉴定和遗传多样性评价。
表4 黄花菜品种基因型数据
Table 4 Genotype data of d Hemerocallis citrina

续表4

续表4

- 我用了一个很复杂的图,帮你们解释下“23版最新北大核心目录有效期问题”。
- 重磅!CSSCI来源期刊(2023-2024版)最新期刊目录看点分析!全网首发!
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?
- 《农业经济》论文投稿解析,难度指数四颗星,附好发选题!
- 期刊知识:学位论文完成后是否可以拆分成期刊论文发表?
- 号外!出书的人注意啦:近期专著书号有空缺!!

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



