钴强化铁磁体活化过一硫酸盐的实验研究
偶氮染料因分子结构中含有偶氮基(—N
过硫酸盐高级氧化工艺(SR-AOPs)是降解和矿化有机染料废水的有效方法。过一硫酸盐(PMS)的活化主要基于均相或非均相催化剂形式的过渡金属,通过多价态金属之间的得失电子,以催化PMS产生活性自由基(·SO
在所有过渡金属中,铁元素来源丰富,铁磁体(如Fe2O3和Fe3O4)可以通过外加磁场将催化剂粉末从反应体系中分离,使其回收与重复利用变得高效快捷[7]。钴基金属氧化物具有较强的氧化还原能力,其活化过硫酸盐效果较好,Co3O4具有反尖晶石结构,可有效减少钴离子的浸出[8]。此外,铁钴复合材料中的双金属存在强键合作用,可改善电子传导方式,减少金属离子浸出[9]。由此可见,铁钴复合材料既有高效的降解效率,又能快速从反应体系中分离。
本文以偶氮染料中的金橙Ⅱ为目标污染物,探究过渡金属中的铁钴氧化物复合材料活化PMS的效能,采用多种表征技术对复合材料进行理化性质的分析,考察钴复合量、催化剂投加量、PMS投加量、金橙Ⅱ浓度、初始pH、共存阴离子对铁钴复合材料/PMS体系降解金橙Ⅱ效果的影响,进行多次重复实验并探讨铁钴复合材料活化PMS降解金橙Ⅱ的机理,以期为过渡金属氧化物复合材料活化过硫酸盐降解偶氮染料提供参考依据。
1 实验材料和方法
1.1 实验试剂
六水合氯化铁(FeCl3·6H2O)、六水合硝酸钴[Co(NO3)2·6H2O]、金橙Ⅱ(C16H11N2NaO4S,图1)、过一硫酸氢钾(2KHSO5·KHSO4·K2SO4)、乙二醇(C2H6O2,EG)、聚乙烯吡咯烷酮(PVP)、浓硫酸(H2SO4)、氢氧化钠(NaOH)、碳酸氢钠(NaHCO3)、氯化钠(NaCl)、硝酸钠(NaNO3)、磷酸二氢钠(NaH2PO4)、甲醇(CH3OH)、叔丁醇(C4H10O)、糠醇(C5H6O2)。实验试剂均为分析纯,购自上海麦克林生化科技有限公司。实验用水为去离子水。
图1
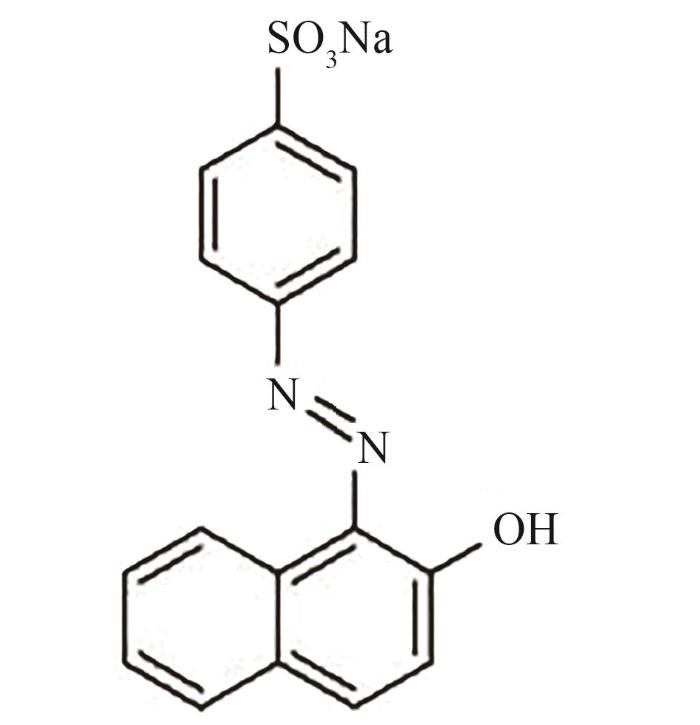
图1 金橙Ⅱ的分子结构
Fig.1 Molecular structure of orange Ⅱ
1.2 实验仪器
101-4A型电热恒温鼓风干燥箱(天津市泰斯特仪器有限公司)、SX2-5-12型箱式电阻炉(天津泰斯特仪器有限公司)、KQ-5200DE型超声波清洗机(昆山市超声仪器有限公司)、PHSJ-4A型pH计(上海雷磁仪器有限公司)、UV-2450型岛津紫外可见分光光度计(广州市化兴科学仪器有限公司)、LE204E/02型电子分析天平(梅特勒-托利多仪器有限公司)、IS-RDD3型恒温振荡摇床(南京庚辰科学仪器有限公司)。表征仪器:Bruker D8型X射线衍射仪(XRD,德国布鲁克分析仪器公司);QUANTA FEG 450型扫描电子显微镜(SEM,美国FEI公司);X-Max型能量色散X射线光谱仪(EDS,英国牛津仪器有限公司);7404型振动样品磁强计(VSM,美国LakeShore公司);Escalab 250Xi型X射线光电子能谱仪(XPS,美国Thermo Fisher Scientific)。
1.3 复合材料的制备
采用分析天平准确称取不同质量的FeCl3·6H2O,将其加入50 ml乙二醇溶液中,将烧杯置于超声波清洗机中振荡至固体粉末完全溶解,随后加入2 g聚乙烯吡咯烷酮表面活性剂,搅拌30 min后加入1 g NaOH,继续均匀搅拌至溶液呈砖红色,加入一定浓度的Co(NO3)2·6H2O溶液。之后将混合溶液转移至100 ml聚四氟乙烯内衬的不锈钢反应釜中,置于200℃的电热恒温鼓风干燥箱中反应8 h后冷却至室温。反应釜内产生具有磁性的红棕色固体粉末,用磁铁收集样品并用去离子水反复洗涤数次。最后将样品在马弗炉中以450℃煅烧4 h得到实验复合材料。
1.4 OGⅡ降解实验
首先将一定质量的铁钴复合材料以及过一硫酸盐先后投入装有100 ml OGⅡ溶液的锥形瓶中,迅速将锥形瓶放入恒温摇床(25℃,180 r/min)中振荡。每隔10 min用移液枪取样2 ml,立即注入装有1 ml甲醇的离心管中以淬灭剩余活性自由基。使用一次性注射器吸取离心管中的溶液,过0.45 μm水系滤膜以去除溶液中剩余的粉末催化剂。最后用紫外可见分光光度计测量溶液的吸光度(最大吸收波长λ=484 nm),以计算OGⅡ剩余浓度,其降解率通过
式中,C0和Ct 分别为反应溶液的初始浓度和反应至t时的浓度,mg/L。
为了获取OGⅡ降解过程中的反应动力学参数,在本实验中,OGⅡ降解过程可采用准一级动力学模型进行拟合与评估,如
式中, k为准一级反应动力学常数,min-1。
2 实验结果与讨论
2.1 最佳复合量的确定
五种不同铁钴摩尔比的Co3O4/Fe2O3复合材料活化PMS降解OGⅡ的效果如图2所示。根据钴复合量的不同将材料命名为CoFe-x(x=n(Co3O4)/n(Fe2O3))。实验条件如下:CoFe-x投加量为1.0 g/L、PMS投加量为0.4 mmol/L、OGⅡ初始浓度为30 mg/L、pH=6.2。由图可知,所有的复合材料均有较高的降解性能,随着钴复合量的增加,OGⅡ的降解率随之增高,当n(Co3O4)∶n(Fe2O3)=0.1时,复合材料展现出最佳的催化性能,CoFe-0.1/PMS体系在60 min内能够去除95.65%的OGⅡ。然而继续增大复合材料中钴的比例,其催化效果有所下降。原因可能在于复合材料中Co3O4的引入增强了双金属间的协同效应,从而使催化效率得到提升,当继续增大Co3O4的比例时,过量的Co3O4磁性纳米粒子与Fe2O3发生团聚作用,降低了复合催化剂表面的活性位点数量,从而降低了OGⅡ的去除率。因此,选用CoFe-0.1进行后续实验。
图2
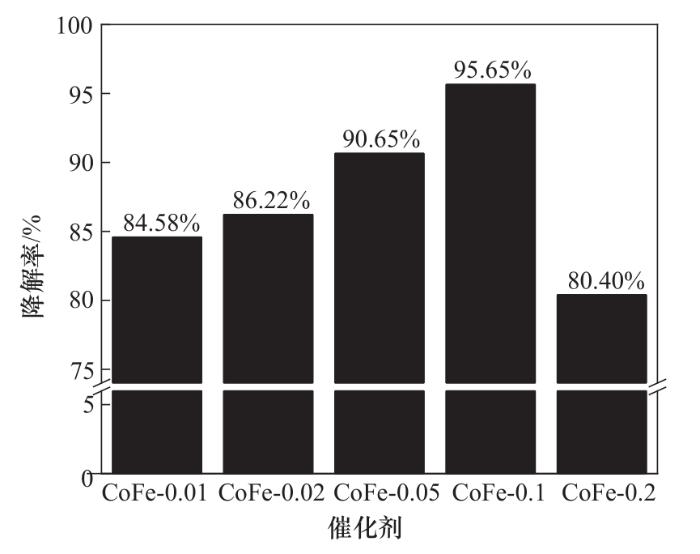
图2 CoFe-x/PMS体系对OGⅡ降解的影响
Fig.2 Effect of CoFe-x/PMS system on degradation of OGⅡ
2.2 复合材料的表征
2.2.1 XRD分析
从图3(a)的XRD谱图中可以看出,衍射峰的峰形清晰,表明复合材料结晶度良好。纯Fe2O3在衍射角2θ为30.2°、35.6°、43.3°、53.7°、57.3°和62.9°的衍射峰分别对应(220)、(311)、(400)、(422)、(511)和(440)晶面,与磁赤铁矿γ-Fe2O3标准卡片(PDF#39-1346)基本吻合[10]。纯Co3O4在衍射角2θ为19.0°、31.3°、36.9°、38.5°、44.8°、55.7°、59.4°和65.2°的衍射峰分别对应(111)、(220)、(311)、(222)、(400)、(422)、(511)和(440)晶面,所有的衍射峰与Co3O4标准卡片(PDF#42-1467)的数据一致[11]。复合材料中,两种金属氧化物的特征峰都没有发生位移,说明两种单材料复合后的晶体结构都未发生变化,复合材料倾向于以金属氧化物的混合态形式存在。由图3(b)可知,反应前后,CoFe-0.1的XRD谱图无明显变化,因此CoFe-0.1具有良好的稳定性。XRD表征结果表明:实验成功制备了催化性能良好、晶体结构稳定的CoFe-0.1复合材料。
图3

图3 CoFe-0.1的XRD谱图
Fig.3 XRD patterns of CoFe-0.1
2.2.2 SEM和EDS分析
图4为CoFe-0.1的SEM图像。由图可知,Co3O4/Fe2O3复合材料呈现出纳米球形颗粒的形状,其直径为100~400 nm,这种球形结构外表面积较大,可为PMS提供更多的活性反应位点,有利于在催化过程中促进PMS和OGⅡ的相互作用。Co3O4和Fe2O3都是球形颗粒,因此很难将其区分。由于两种材料的磁性作用,大量的纳米颗粒聚集在一起,造成了严重的团聚现象。
图4

图4 CoFe-0.1的SEM图像
Fig.4 SEM images of CoFe-0.1
采用EDS对CoFe-0.1进行了元素组成分析。从图5中可以看出,复合材料表面主要由Co、Fe和O三种元素组成,其原子百分数分别为14.41%、31.04%和54.55%。去除部分铁、钴氧化物杂质后,复合材料符合CoFe-0.1元素比构成。
图5
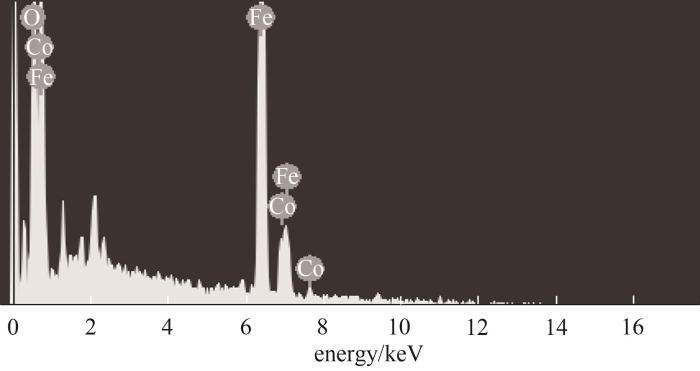
图5 CoFe-0.1的EDS谱图
Fig.5 EDS image of CoFe-0.1
2.2.3 VSM分析
在室温下(300 K)采用VSM对纯Co3O4、纯γ-Fe2O3和CoFe-0.1复合材料的磁性进行了研究,其磁滞回线如图6所示。其中,测试磁场范围为-12500~12500 Oe (1Oe=79.5775 A/m),三种材料的磁滞回线均呈S形。如图6(a)所示,纯Co3O4磁性较弱,具有轻微的磁滞现象,通过计算得到其饱和磁化强度(Ms)和剩磁(Mr)值分别为0.5 emu/g和0.02 emu/g。纯γ-Fe2O3的Ms为59.1 emu/g,Mr为6.9 emu/g。由于Co3O4的引入,CoFe-0.1复合材料的Ms(57.7 emu/g)低于纯γ-Fe2O3样品,并且也出现了磁滞现象。以上结果说明,磁性CoFe-0.1复合材料是一种具有矫顽力(131.7 Oe)的铁磁性材料。如图6(d)所示,CoFe-0.1复合材料可以在外加磁场下与水溶液分离,这有利于从反应后的溶液中回收CoFe-0.1并加以利用,避免对环境造成二次污染。
图6
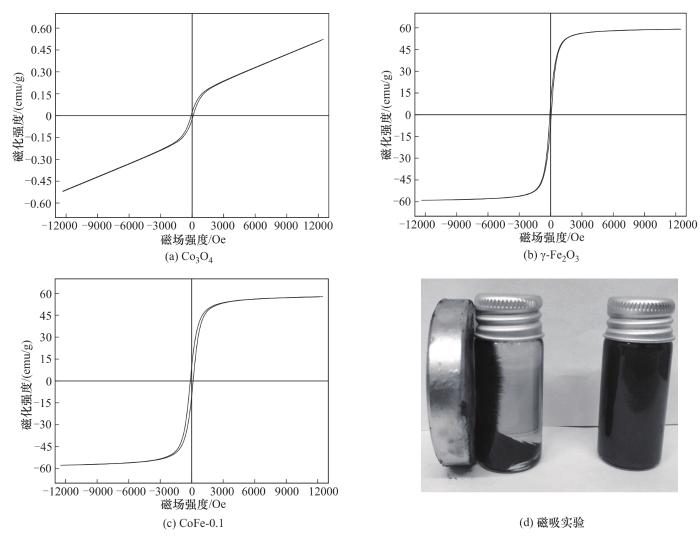
图6 CoFe-0.1及其对应金属氧化物的VSM谱图
Fig.6 VSM spectra of CoFe-0.1 and its corresponding metal oxides
2.2.4 XPS分析
XPS分析可以进一步了解复合材料表面的成分和化学状态。反应前后CoFe-0.1的XPS能谱如图7所示。图7(a)中的曲线显示出CoFe-0.1中存在Co、Fe、O、C四种元素,其中C 1s峰(284.8 eV)用来校正每种元素的结合能[12]。反应前后全扫谱中各种元素没有发生明显的变化,证明复合材料具有良好的化学稳定性。
图7

图7 CoFe-0.1反应前后的XPS谱图
Fig.7 XPS spectra of CoFe-0.1 before and after reaction
图7(b)为铁元素的精细谱,Fe 2p3/2和Fe 2p1/2的结合能分别为710.80 eV和723.90 eV,其自旋解离能为13.30 eV,并且718.80 eV处出现了卫星峰,表明铁元素在复合材料中以Fe3+的形式存在[13]。铁元素的价态变化相对较小,因此只有少量铁元素参与了电子转移。图7(c)为钴元素的精细谱,Co 2p的XPS光谱显示出低能带(Co 2p3/2)和高能带(Co 2p1/2),其对应的结合能分别为779.70 eV和794.70 eV,两个峰之间的自旋解离能为15.00 eV,证明钴元素以Co3O4的形式存在,这与文献报道的一致[14]。Co 2p3/2可以分峰成Co3+(779.85 eV)和Co2+(781.42 eV)两个分量,Co2+在反应前后减少了14.45%,而Co3+则增加了15.24%,表明Co2+/Co3+的氧化还原循环参与了催化降解反应,并且说明钴元素的价态变化是造成OGⅡ氧化降解的主要原因之一。
如图7(d)所示,氧的精细谱可分峰为三个结合能为529.91、531.45、532.95 eV的峰,分别对应于晶格氧(O2-,Olatt)、表面氧(—OH,Osurf)和吸附氧(H2O,Oads)[15]。其相对含量分别由反应前的68.41%、23.88%和7.71%变化成反应后的67.70%、20.13%和12.17%,表明活性氧物种在PMS活化中起着关键作用。晶格氧的减少说明其参与了Co3+/Co2+和Fe3+/Fe2+之间的氧化还原转化[16],表面氧的减少可能是由于材料表面羟基基团与OGⅡ发生了反应,而吸附氧含量的提高可能归因于Co2+与H2O的解离吸附耦合生成CoOH+[17]或晶格氧中氧化出的O2在CoFe-0.1表面的吸附[18]。
2.3 不同体系去除OGⅡ
图8(a)是不同体系去除OGⅡ的性能比较。实验条件如下:材料投加量为1.0 g/L、PMS投加量为0.4 mmol/L、OGⅡ初始浓度为30 mg/L、pH=6.2。由图可知,单独存在于溶液中的PMS和Co3O4对OGⅡ基本没有去除作用。Fe2O3、CoFe-0.1对OG Ⅱ的吸附率分别为28.21%、29.81%,结果表明单一金属氧化物催化剂对OGⅡ的吸附效果有限,复合材料的吸附效果没有提升,并且两种材料在60 min内没有出现解吸现象;单独的Fe2O3活化PMS降解OGⅡ的效率较低(57.78%),而Co3O4/PMS体系及CoFe-0.1/PMS体系对OGⅡ的去除率分别达到了76.60%和94.63%,说明钴基尖晶石氧化物可以有效活化PMS,而复合材料中双金属的协同作用极大地提高了催化效率。
图8
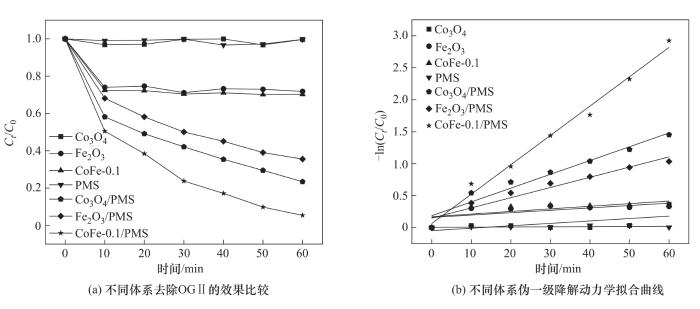
图8 不同体系对OGⅡ去除率的影响
Fig.8 Effect of different systems on removal rate of OGⅡ
不同体系去除OGⅡ的动力学拟合曲线如图8(b)所示。由图可知,单一金属氧化物和复合材料吸附OGⅡ的过程不符合准一级动力学模型,而在向Co3O4、Fe2O3和CoFe-0.1反应溶液中投加PMS后,三种体系降解OGⅡ的过程均符合准一级动力学模型,其速率常数分别为0.0216、0.0160、0.0459 min-1。虽然CoFe-0.1活化PMS降解OGⅡ的过程中存在吸附作用,但其影响程度较小(R2=0.9896)。降解动力学研究表明:相较于单一金属氧化物催化剂,CoFe-0.1复合催化剂能够快速活化PMS,促进反应的进行,实现OGⅡ的高效降解。
2.4 降解体系影响因素研究
2.4.1 催化剂投加量对OGⅡ降解的影响
图9为催化剂投加量对CoFe-0.1活化PMS降解OGⅡ的影响。实验条件为:PMS投加量为0.4 mmol/L、OGⅡ初始浓度为30 mg/L、pH=6.2。结果显示,CoFe-0.1投加量由0.4 g/L增加到1.0 g/L时,OGⅡ的降解率逐渐由62.50%升高至94.35%,其反应速率常数也由0.0141 min-1增加至0.0418 min-1,这表明CoFe-0.1的投加量增大,吸附能力也随之增强,并且复合材料为PMS提供了更多的反应位点,加快了PMS的活化速率[19]。当CoFe-0.1投加量继续增加至1.2 g/L时,反应速率迅速下降至0.0268 min-1,原因在于投加量增大时,溶液中的磁性催化剂颗粒发生团聚现象,导致复合材料比表面积降低,活性位点相对减少,使得OGⅡ的降解率被抑制[20]。因此,考虑到经济性,后续实验中选择CoFe-0.1的最佳投加量为1.0 g/L。
图9
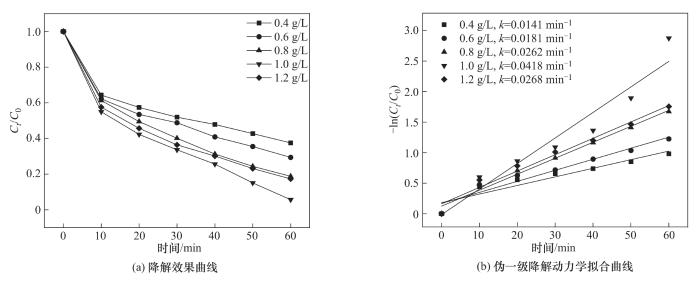
图9 催化剂投加量对OGⅡ降解率的影响
Fig.9 Effect of catalyst dosage on degradation rate of OGⅡ
2.4.2 PMS投加量对OGⅡ降解的影响
图10为PMS投加量对CoFe-0.1活化PMS降解OGⅡ的影响。实验条件为:CoFe-0.1投加量为1.0 g/L、OGⅡ初始浓度为30 mg/L、pH=6.2。结果显示,PMS投加量由0.2 mmol/L增加至0.4 mmol/L时,OGⅡ的降解速率明显增大,由最低的79.20%增加到最高时的94.96%,此时反应速率常数最大值为0.0469 min-1;这是由于反应体系中增大PMS的投加量,会生成更多的活性自由基(·OH和·SO
图10
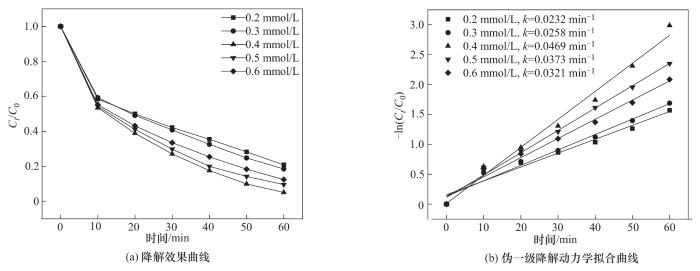
图10 PMS投加量对OGⅡ降解率的影响
Fig.10 Effect of PMS dosage on degradation rate of OGⅡ
2.4.3 OGⅡ浓度对OGⅡ降解的影响
图11为OGⅡ初始浓度对CoFe-0.1活化PMS降解OGⅡ的影响。实验条件为:CoFe-0.1投加量为1.0 g/L、PMS投加量为0.4 mmol/L、pH=6.2。结果显示,在10 mg/L的低浓度时,OGⅡ的去除率很高,仅30 min内去除率就达到了96.91%,相应的反应速率常数最大值为0.0863 min-1,这是吸附加降解双重作用的结果。随着OGⅡ初始浓度的升高,降解率升高至93.70%后再逐渐降低,反应速率常数也由0.0411 min-1减小至0.0138 min-1。当OGⅡ初始浓度达到90 mg/L时,反应60 min后OGⅡ去除率仍能达到61.79%,这些结果表明,CoFe-0.1/PMS体系对高浓度染料废水表现出优异的处理效率,因此后续实验中选择OGⅡ最佳初始浓度为30 mg/L。
图11

图11 OGⅡ浓度对OGⅡ降解率的影响
Fig.11 Effect of OGⅡ concentration on degradation rate of OGⅡ
2.4.4 初始pH对OGⅡ降解的影响
图12为初始pH对CoFe-0.1活化PMS降解OGⅡ的影响。实验条件为:CoFe-0.1投加量为1.0 g/L、PMS投加量为0.4 mmol/L、OGⅡ初始浓度为30 mg/L。结果显示,OGⅡ在酸碱环境中都有良好的降解率,当pH为4.0时,OGⅡ降解率为87.98%,反应速率常数为0.0328 min-1,在强酸性环境中,复合材料易溶解浸出金属离子,导致催化剂活性降低[23]。在弱碱性环境中(当pH<9.4时),HSO
图12
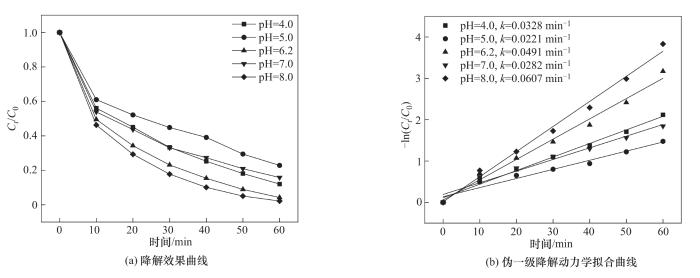
图12 初始pH对OGⅡ降解率的影响
Fig.12 Effect of initial pH on degradation rate of OGⅡ
2.4.5 共存阴离子对OGⅡ降解的影响
各种无机阴离子在天然水体中普遍存在,这可能会影响PMS活化体系中自由基的产生以及目标污染物的去除。本实验将NaHCO3、NaCl、NaNO3、NaH2PO4分别添加到反应溶液中并评估其对OGⅡ降解效果的影响,如图13所示,不同浓度的无机阴离子对OGⅡ的降解表现出截然不同的作用。
如图13(a)、(b)所示,HCO
如图13(c)所示,与对照组相比,在含低浓度Cl-溶液中,OGⅡ的降解率降低,当Cl-浓度增大时,OGⅡ的降解率反而升高。这是因为在低浓度的Cl-溶液中,Cl-可被·SO
图13
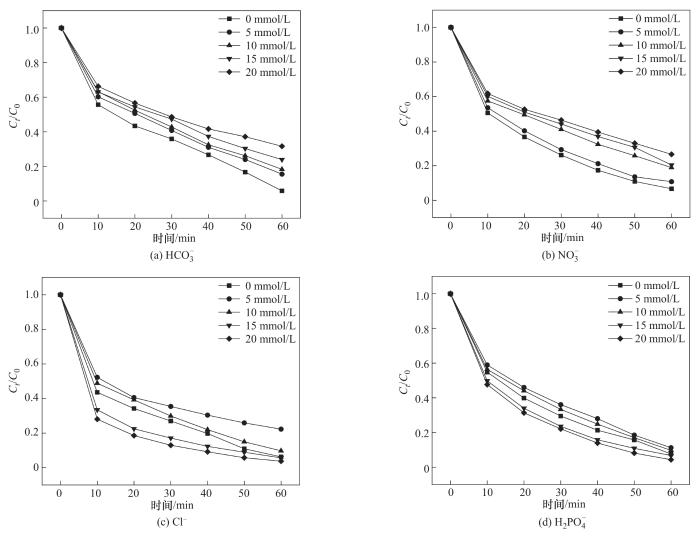
图13 共存阴离子对OGⅡ降解率的影响
Fig.13 Effect of coexisting anions on degradation rate of OGⅡ
2.5 催化性能稳定性
催化剂的重复使用次数和稳定性是实际应用中的重要方面,本实验对CoFe-0.1进行了四次连续的重复实验。实验条件如下:CoFe-0.1投加量为1.0 g/L、PMS投加量为0.4 mmol/L、OGⅡ初始浓度为30 mg/L、pH=6.2。每次实验结束后,用磁铁收集反应溶液中剩余的固体粉末催化剂,并用去离子水和甲醇分别冲洗三遍,随后将其放置于100 ℃的电热恒温鼓风干燥箱中干燥4 h,将干燥后的催化剂重新研磨分散用于下一步的催化降解实验。如图14所示,OGⅡ在四次实验中的降解率分别为95.56%、86.74%、78.81%、68.85%,表明CoFe-0.1具有较好的可重复使用性和较高的稳定性。
图14
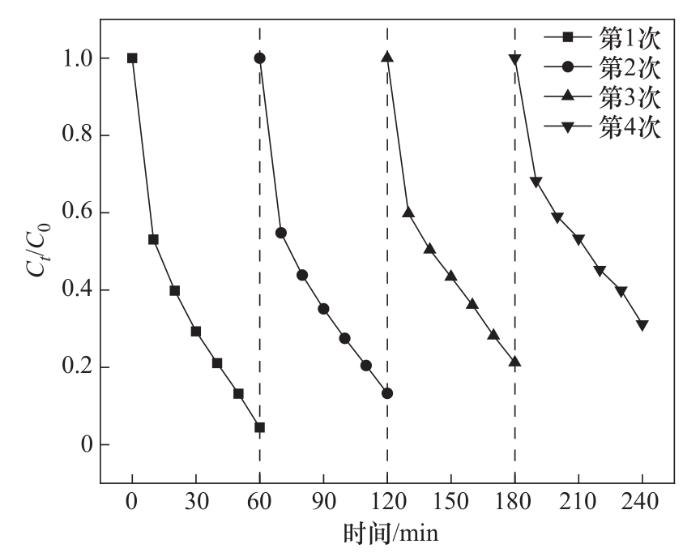
图14 CoFe-0.1的重复利用实验
Fig.14 Reuse experiment of CoFe-0.1
2.6 淬灭实验和催化机理
自由基淬灭剂的使用可以确定CoFe-0.1/PMS体系降解OGⅡ过程中产生的活性自由基种类,以便更好地了解潜在的反应机理。实验条件为:催化剂投加量为1.0 g/L、PMS投加量为0.4 mmol/L、OGⅡ浓度为30 mg/L、pH=6.2,淬灭剂浓度均为200 mmol/L。一般情况下,·OH和·SO
图15
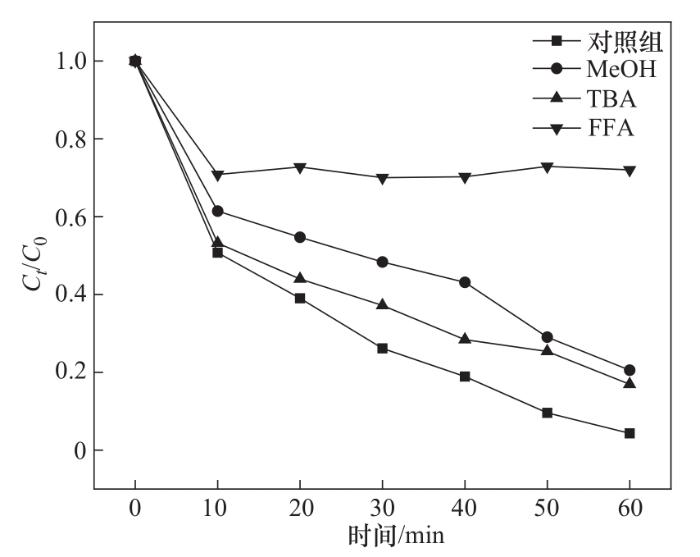
图15 不同淬灭剂对OGⅡ降解率的影响
Fig.15 Effect of different quench agents on the degradation rate of OGⅡ
根据以上结果和先前的研究,提出了CoFe-0.1/PMS体系降解OGⅡ的可能反应机理,如图16所示。PMS溶解于水中产生HSO
图16

图16 CoFe-0.1/PMS体系的反应机理
Fig.16 Reaction mechanism of CoFe-0.1/PMS system
3 结论
(1)通过溶剂热法后高温煅烧的方式成功制备了符合化学元素计量比的铁钴双金属氧化物复合材料CoFe-0.1,其在室温条件下能够有效活化PMS降解偶氮染料OGⅡ,通过XRD、SEM、VSM、XPS等表征方法分析了复合材料的理化性质。
(2)在CoFe-0.1投加量为1.0 g/L、PMS投加量为0.4 mmol/L、OGⅡ浓度为30 mg/L、pH=6.2的最佳实验条件下,60 min内CoFe-0.1/PMS体系对OGⅡ的降解率可达到95.00%以上。复合材料稳定性相对较好,重复使用4次后仍有68.85%的降解率。OGⅡ的降解过程与准一级反应动力学模型拟合较好。
(3)无机阴离子中,HCO
(4)自由基淬灭实验表明,CoFe-0.1/PMS体系降解OGⅡ的过程中产生的主要活性氧物种为·OH、·SO
- 我用了一个很复杂的图,帮你们解释下“23版最新北大核心目录有效期问题”。
- 重磅!CSSCI来源期刊(2023-2024版)最新期刊目录看点分析!全网首发!
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?
- 《农业经济》论文投稿解析,难度指数四颗星,附好发选题!
- 期刊知识:学位论文完成后是否可以拆分成期刊论文发表?
- 号外!出书的人注意啦:近期专著书号有空缺!!

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



