金属纳米颗粒辅助木质纤维素暗发酵生物制氢的研究进展
引 言
随着人口和工业化的快速增长,全球对能源的需求日益增加,化石燃料储备有限且会对环境造成不利影响,因此寻找代替化石燃料的可再生能源成为全世界广泛关注的问题[1]。相比其他能源,氢气具有可再生、零排放、能量密度高、热效率高等优势,使其成为21世纪备受重视的清洁能源[2]。氢能源来源广泛,不仅可以来自天然气、石油、煤炭等天然资源,还可以通过电解水产生[3]。目前,以废弃生物质为原料通过微生物制氢也成为氢气的一个重要来源,这些有机废物原料可再生,来源广泛可大量获得,使得生物制氢具有广阔的发展前景[4-5]。
生物制氢主要有四种途径:光解水产氢、光发酵产氢、暗发酵产氢和光-暗联合发酵产氢[6-9]。暗发酵由于无须光照、产氢速率快、耗能低、微生物类群广泛且可使用多种有机底物,是生物制氢最常用的工艺[10-12]。Web of Science引文索引中2004~2020年间涉及生物制氢各种主要方法的文章发表数量如图1(a)所示。可知暗发酵产氢相关的文章数量明显高于其他几种方法,且随年份呈现迅速增长趋势,近五年来尤为显著,2020年发表的文章数量接近250篇。相比之下其他几种生物制氢方法的文章数量较少且随年份增长缓慢。暗发酵产氢主要通过三种途径:丁酸型发酵、混合酸发酵以及NADH途径。参与暗发酵的碳水化合物主要是葡萄糖,主要产生乙酸、丁酸与氢气,具体反应式如式(1)~
图1
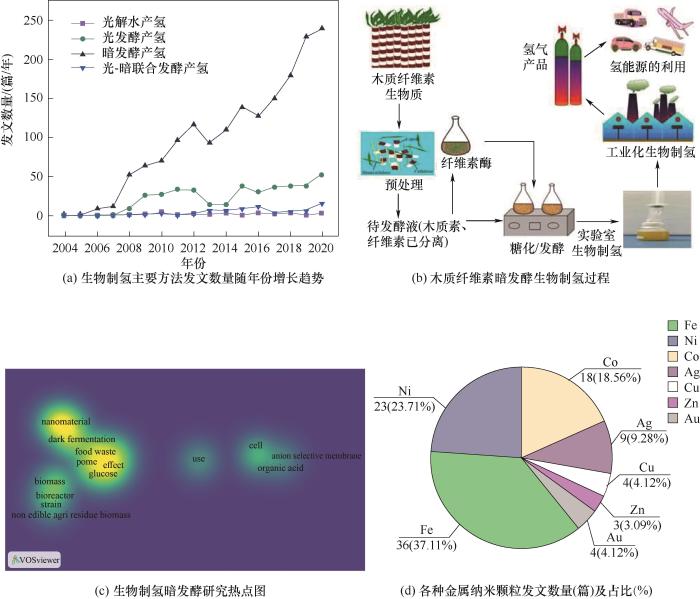
图1 木质纤维素暗发酵生物制氢及相关纳米颗粒的文献计量学分析
Fig.1 Bibliometric analysis of dark fermentative bio-hydrogen and related MNPs
可以看出,暗发酵生物制氢的最高产氢率为4 mol H2/(mol葡萄糖),60%以上的产物为乙酸、丁酸、乙醇等物质,产氢量低、底物转化率低是暗发酵存在的问题[8-9, 13]。在各种有机底物中,木质纤维素生物质是最合适的底物,因为其单体形式的葡萄糖含量高[14],且来源广泛,例如可从稻草秸秆、甘蔗渣、玉米芯和木屑等中获得[9]。木质纤维素的高纤维素含量、可再生性和巨大的可利用性使其成为大规模生物制氢最常用的有机基质,其暗发酵制氢过程如图1(b)[8]。
然而木质纤维素中含有大量难降解的木质素(10%~25%),木质素通过化学键与半纤维素结合并将纤维素包裹在其中,阻碍了对纤维素的利用[15-16],因此必须进行预处理以促进纤维素的暴露、提高其水解生成单糖的效率。针对木质纤维素的预处理,已经发展了许多物理、化学和生物手段,但这些方法都存在不足,例如物理方法能耗高,化学法成本高且会产生对环境有害的废物,生物法反应速率慢、产量低[17-18]。这些方法由于成本较高不适合投入工业应用,因此需要开展深入研究以提高木质纤维素暗发酵生物制氢的效率[19]。暗发酵生物制氢效率低主要受制于暗发酵本身产氢率与底物转化率低这两个方面的原因,而这两个过程都具有的共同点是受酶的控制。在木质纤维素的预处理过程中,由于缺乏对木质素的有效降解以及纤维素酶水解效率低、生产成本高,导致产氢量较少。而在暗发酵过程中氢化酶通过催化质子还原起着至关重要的作用,酶的催化效率低直接导致产氢效率低。因此,酶起着控制整个生物制氢过程的关键作用[9],通过提高酶的性能是提高生物制氢效果直接快速的手段。此外,微生物细胞的代谢活动、细胞之间以及菌群之间的相互作用也会对暗发酵产氢过程产生影响。
纳米材料(nanomaterials)具有量子尺寸效应、比表面积大、电导率高等特点[20-21],展现出高效的吸附能力和催化效率,且可以在非常低的浓度下诱导微生物代谢,在生物技术中有广阔的应用前景[22-27]。近年来,纳米技术作为生物科学领域前沿技术,有望成为克服暗发酵瓶颈的新手段[5, 8, 28]。通过对暗发酵生物制氢文章的主题、关键词进行热度分析[图1(c)],可以看出纳米材料的出现频率很高且与暗发酵关系紧密。近年来,金属纳米颗粒(metal nanoparticles,MNPs)已经被利用于改善生物制氢[23-26, 29-30]。图1(d)展示了2013~2021年应用于暗发酵生物制氢的各种金属纳米材料颗粒发文数量占比,其中最常用的是铁和镍纳米颗粒(占比超过60%),以及钴、银、铜、锌等。金属纳米材料在暗发酵生物制氢中的作用主要有:(1)提高酶的稳定性,增加生物预处理过程中木质素和半纤维素的去除[31]和纤维素的水解,实现产氢量的提高[1, 8-9, 32-33];(2)消耗暗发酵过程中不需要的氧,降低氧化还原电位[9, 23-24, 30],促进氢化酶的合成和活性的提高;(3)影响暗发酵产氢体系中微生物细胞的代谢,促进细胞电子传递;(4)影响暗发酵产氢体系中微生物的群落结构。本文介绍了金属纳米颗粒辅助木质纤维素暗发酵生物制氢的机理及影响因素,总结了各种金属纳米颗粒应用于暗发酵生物制氢的研究进展,并对仍存在的难题及前景进行了总结与展望。
1 金属纳米颗粒的生物相容性及与酶的作用机理
1.1 金属纳米颗粒的生物相容性
纳米颗粒通常指直径在1~100 nm范围内的粒子[7]。金属纳米颗粒具有量子尺寸效应、表面效应和优异的导电性能,这使其展现出良好的生物相容性。在浓度为0.01 mg/ml时,直径为70 nm的纳米颗粒可提供0.8 m2/L的总表面积。纳米颗粒微小的尺寸使其能被细胞吸收,从而与细胞发生作用[34]。如图2所示,直径小于100 nm的颗粒可以通过受体介导的内吞作用(receptor mediated endocytosis)进入细胞[35]。此外,纳米颗粒还可以被蛋白质包裹并与其结合,或停留在细胞表面[34]。附着在细胞表面的金属纳米颗粒可以与细胞膜上的酶或受体蛋白发生作用,还能作为一些微生物细胞进行胞外呼吸的末端电子受体。纳米颗粒微小的体积和巨大的比表面积有利于细胞间和细胞内的电子传递[6-7]。细胞内的金属纳米颗粒通过加快水解和产酸过程中酶组之间的电子传递速率,促进有机物的氧化,从而促进微生物的代谢过程[36]。
图2
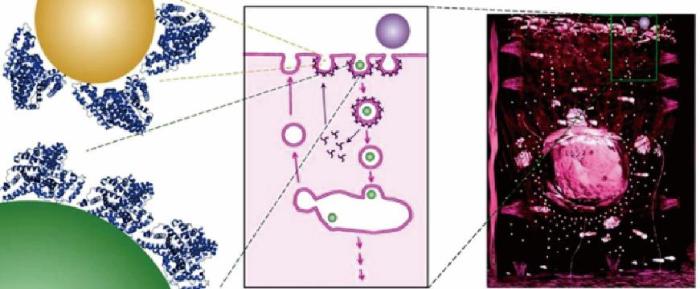
图2 纳米颗粒与细胞的作用(受体介导的内吞作用:纳米颗粒被蛋白质冠层包裹)[35]
Fig.2 Interaction between nanoparticles and cell(receptor mediated endocytosis: nanoparticles are coated by a protein corona)[35]
1.2 金属纳米颗粒与酶及微生物的作用机理
铁、镍、钴、镁、锰、锌、铜等多种金属以宏量和微量元素的形式构成微生物的营养介质[37-39],这些金属及其氧化物纳米颗粒即使在低浓度下也可能产生很大的影响[8, 40]。金属纳米颗粒可以通过固定或吸附机质显著改变反应介质,并表现出优异的催化性能[41]。此外,改性后的金属纳米颗粒还可以从反应介质中回收,用于后续的反应[42]。近年来,学者们通过研究揭示了纳米颗粒对酶的产生和效率的影响。图3显示了酶与纳米颗粒的不同附着/固定模式[43],主要包括:酶在纳米颗粒上的非共价物理吸附、酶与纳米粒子的共价结合(多点附着)、酶的共价交联以及通过胶束将酶微囊化。这些作用均可以对纤维素酶的稳定性和水解效率产生促进作用。
图3
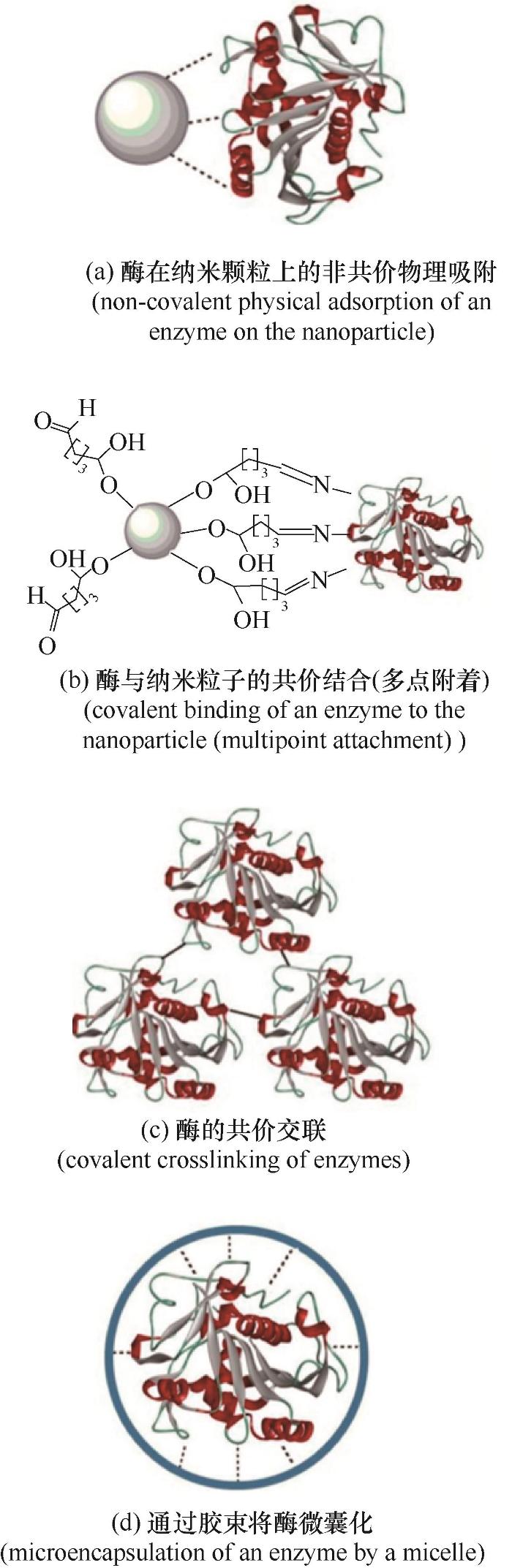
图3 通过共价和非共价力引入纳米颗粒促进酶的稳定化[43]
Fig.3 Enzyme stabilization by immobilization introduces additional covalent and non-covalent forces to nanoparticles[43]
金属及其氧化物纳米颗粒对酶的产生和活性有积极影响。Kumar等[44]揭示了过渡金属氧化物如Fe2O3纳米颗粒(Fe2O3NPs)不仅显示出高效的催化性能及对反应介质的改善,且对酶的固定化效率达60%~80%。金属纳米颗粒的复合形式(nanocompostie particles)如Fe3O4/藻酸盐纳米复合颗粒能够防止培养基在高浓度下中毒,并保持微生物群落的活性,提高酶的产量[45]。此外,金属纳米颗粒还可以通过改变微生物的新陈代谢和菌丝生长来影响微生物生长,从而提高酶的产量[46]。
2 金属纳米颗粒对木质纤维素暗发酵产氢相关酶的影响
2.1 金属纳米颗粒促进木质纤维素水解影响产氢的作用机理
金属纳米颗粒用于木质纤维素的预处理主要包括两个方面:(1)使用功能化金属纳米颗粒直接水解木质纤维素;(2)通过吸附或共价键结合将水解酶固定在金属纳米颗粒上,强化酶的稳定性和重复使用性能。
2.1.1 功能化金属纳米颗粒对木质纤维素的预处理
为使金属纳米颗粒能够实现对木质纤维素的高效降解,需要对其进行功能化改性,例如采用磁性金属内核、用化学试剂修饰纳米颗粒表面等。目前对功能化金属纳米颗粒预处理木质纤维素的研究主要集中在酸功能化磁性金属纳米颗粒(acid-functionalization magnetic nanoparticles)。由于纳米颗粒具有很大的比表面积,其表面能够负载大量的酸,并且纳米颗粒微小的尺寸使它容易穿过木质纤维素生物质的细胞壁,与其中的木质纤维素相互作用[47]。酸功能化磁性纳米颗粒对木质纤维素的预处理与酸化学法预处理类似,但其表面能够与 —SO3H、—COOH、—OH等酸性基团结合,提供大量酸性位点,并且具有磁性的金属纳米颗粒还可以回收循环利用,避免了传统化学预处理中酸的大量使用,大大降低了处理成本[48]。Gill等[49]最早合成了烷基磺酸和全氟烷基磺酸功能化的二氧化硅包覆的磁性纳米颗粒(AS-SiMNPs和PS-SiMNPs)[图4(a)],他们认为在这些磁性纳米颗粒表面形成的H3O+通过水解反应促进纤维素转化为葡萄糖。Peña等[50]研究了全氟烷基磺酸和烷基磺酸功能化的CoFe2O4纳米颗粒(PS-Co-MNPs和AS-Co-MNPs)对纤维素二糖的水解作用,发现AS-Co-MNP通过破坏β-1,4-糖苷键实现纤维素二糖的水解[图4(b)],使纤维素二糖的转化率达到78%。Wang等[42]随后又研究了PS-Co-MNPs和AS-Co-MNPs对麦草秸秆预处理中半纤维素向低聚糖的转化。在80℃处理24 h后,PS-Co-MNPs溶解了24.0%的半纤维素,而AS-Co-MNPs实验组和无添加对照组中半纤维素的溶解率仅为9.1%和7.7%。在160℃处理2 h后,PS-Co-MNPs和AS-Co-MNPs对半纤维素的转化率分别为66.3%和61.2%,而对照组仅为50.9%。Su等[51]制备了一种磺化磁性碳酸纳米颗粒(C-SO3H/Fe3O4NPs)并应用到木质纤维素的水解处理中,处理后甘蔗渣的葡萄糖产率达79.8%。Ingle等[52]分别用两种酸功能化磁性纳米颗粒(Fe3O4-MNPs-Si-AS和Fe3O4-MNPs-Si-BCOOH)强化甘蔗秸秆的预处理,发现添加量均为500 mg/L时得到的糖产量最高,分别为17.06 g/L和15.40 g/L,而仅用硫酸预处理和无处理的样品的糖产量分别为14.63 g/L和0.24 g/L。将酸功能化金属纳米颗粒应用于强化木质纤维素化学预处理,以及通过金属纳米颗粒强化酶的生物法预处理,具有巨大发展潜力,然而,由于金属纳米颗粒用于生物质预处理尚处于起步阶段,目前有关功能化金属纳米颗粒处理木质纤维素的报道非常少[53],相关的机理和进一步的应用还需要进行更多的探索和研究。
图4

Fig.4 Hydrolysis of lignocellulose by functionalized magnetic nanoparticles[49-50]
2.1.2 金属纳米颗粒对酶的固定化作用强化酶对木质纤维素的预处理
从木质纤维素生物质的预处理到最终生物制氢的几乎所有步骤都是由酶介导的,其中大多数酶是蛋白质,其性质和活性受各自的辅基影响很大。作为暗发酵生物制氢过程的关键控制因素,酶的三个主要操作步骤包括:(1)通过漆酶的生物预处理对木质纤维素进行脱木质素;(2)通过纤维素酶将纤维素水解为葡萄糖;(3)通过氢化酶将葡萄糖转化为氢气[54-55]。其中前两个步骤属于木质纤维素的预处理。漆酶是一种铜氧化酶,以分子氧作为电子受体产生自由基,攻击木质素酚类化合物 Cα—Cβ键,实现木质素解聚改性[56]。木质纤维素经第一步预处理后释放了纤维素单体,纤维素酶将其水解成易被利用的糖类。纤维素酶是一个复杂的酶系统,由三个亚基组成:(1)葡萄糖内切酶,它能切割β-(1,4)-糖苷键,使其还原和非还原末端暴露出来;(2)葡萄糖外切酶,它将纤维素转化为纤维二糖和纤维寡糖;(3)β-葡萄糖苷酶,将纤维二糖和纤维寡糖转化为单糖[9, 38, 57]。这些糖再通过暗发酵进一步产生氢气。酶的稳定性和可重复利用性是工业应用中需要考虑的两个关键因素,因为这直接关系到酶预处理的效果和成本。在工业处理过程中,酶促反应通常在高温条件下进行,这会导致酶的结构发生变化,性能降低[58]。固定化是提高酶稳定性和重复利用性的有效方法,纳米材料凭借更大的比表面积、更强的负载能力以及更好的稳定性,逐渐取代了传统的固定化材料[59]。将金属纳米颗粒用于木质纤维素生物质的预处理可以在一般条件下进行,不仅减少化学物质的使用,还提高水解酶的热稳定性和酸碱稳定性[2, 24, 36, 60-61],实现木质纤维素的高效降解[6, 62],使整个过程的成本大大降低。
纳米颗粒通过共价结合或吸附固定在蛋白质或酶上(如图3),对酶的催化活性产生很大影响。酶被附着并固定在纳米颗粒表面上,形成纳米颗粒-蛋白质冠(nanoparticle-protein corona),这种蛋白质冠可导致酶系统的某些结构和功能发生变化,从而增强纳米颗粒的生物相容性[63]。在纳米颗粒-蛋白质冠形成过程中,蛋白质在纳米颗粒上的排列模式进一步影响纳米颗粒的生物活性[64]。酶蛋白对纳米颗粒的亲和力及其占据纳米颗粒表面的能力在酶的固定化作用中起着决定性的作用[65]。酶可以通过范德华力、静电力、疏水或π-π键堆积连接等非共价结合方式与金属纳米颗粒结合。然而,非共价结合存在蛋白质从金属纳米颗粒表面脱落的问题。通过使用交联剂(如戊二醛)实现酶与金属纳米颗粒的共价结合是使用最广泛的酶固定化方法。在共价固定化技术中,纳米颗粒载体表面的化学基团被激活,并与酶蛋白质的赖氨酸氨基侧链、半胱氨酸的巯基、天冬氨酸和谷氨酸残基的咪唑和酚基等发生特异性反应进行结合,形成具有较高强度和稳定性的共价键[66-67]。表1总结了一些学者利用金属纳米颗粒进行纤维素酶和漆酶固定化的研究。众多研究表明采用不同纳米颗粒处理纤维素酶后,纤维素酶的稳定性均得到提高。Cherian等[46]研究了金属纳米颗粒对蛋白质稳定性的影响,发现固定在MnO2NPs上的酶在25℃下的热稳定时间比对照组增加了2 h。Xu等[68]将纤维素酶固定在戊二醛官能化的Fe3O4NPS上,发现其比游离酶具有更好的热稳定性和酸碱稳定性。固定化有助于提高酶对纤维素底物的亲和力,因此可以获得更好的水解性能。Srivastava等[79]用NiCo2O4NPs处理纤维素酶,与对照组在80℃下测试0~8 h,结果表明,纤维素酶在2 h和4 h内的相对活性分别保持在63%和50%,7 h后相对活性比开始时下降了21%。与对照组相比,纤维素酶的稳定性分别提高了68%、50%和41%。Salem等[80]将从废弃污泥中获得的产氢细菌细胞固定在Fe2O3NPs上,使比产氢速率由3.87 L/(L·d) 增加至5.9 L/(L·d),H2产量由0.19 L H2/(g蔗糖)增加至0.3 L H2/(g蔗糖)。Ramírez[61]发现相较于游离纤维素酶(最适温度为50℃,最适pH范围为4.5~5.0),将纤维素酶固定在壳聚糖包覆的Fe3O4NPs上,催化性能提高了1.5倍,热稳定性提高至60℃,pH提高至5.5。且在60℃和70℃孵育4 h后,经稳定的纤维素酶的储存稳定性为初始活性的50%,而未经稳定的纤维素酶的活性仅为初始活性的20%。木质素的降解主要依靠漆酶,Amin等[54]将漆酶固定在改性的Fe3O4@SiO2@KIT-6 NPs上,可以增强漆酶对橄榄果渣的脱木质素作用,在35℃的最佳温度下木质素的去除率高达77.3%。Gou等[76]将漆酶固定在Cu2+改性的Fe3O4-NH2纳米颗粒上进行木质纤维素的预处理,结果显示处理后玉米芯中的木质素降解率达40.76%,在随后的纤维素水解过程中纤维素转化率达到38.37%,同对照组相比提高了23.98%。
表1 各种金属纳米颗粒在纤维素酶/漆酶固定化中的应用
Table 1
| 序号 | 纳米材料 | 固定/结合模式 | 条件参数 |
|---|---|---|---|
| 1 | Fe3O4 NPs [68] | 戊二醛表面修饰共价结合 | T=60℃, pH=4.5 |
| 2 | Fe3O4 NPs [69] | 通过半胱氨酸基团的表面功能化卵清蛋白结合 | T =80℃, pH=4.5 |
| 3 | Fe3O4@SiO2[70] | 物理吸附 | T =70℃, pH=4.0 |
| 4 | Fe3O4 NPs @SiO2[71] | APTES共价结合 | T =25℃, pH=4 |
| 5 | Fe3O4 NPs @SiO2[72] | 甲基丙烯酸缩水甘油酯表面功能化共价结合 | T =50℃, pH=5.0 |
| 6 | Fe3O4@SiO2@KIT-6NPs[54] | APTES共价结合 | T =35℃, pH=4.5 |
| 7 | Fe3O4 NPs /壳聚糖[73] | 戊二醛表面修饰共价结合 | T =60℃, pH=5.5 |
| 8 | Fe3O4 NPs/壳聚糖[74] | 戊二醛表面修饰共价结合 | T =60℃, pH=5.0 |
| 9 | Cu/Fe3O4 NPs[75] | APTES共价结合 | T =80℃, pH=5 |
| 10 | Cu2+ modified Fe3O4-NH2NPs[76] | 亲和吸附 | T =35℃, pH=4.5 |
| 11 | Fe3O4@Au NPs[67] | 通过聚乙二醇和L-天门冬氨酸共价结合 | T =50℃, pH=4.8 |
| 12 | Fe2O3 NPs[77] | 戊二醛表面修饰共价结合 | T =50℃, pH=4.8 |
| 13 | CoFe2O4 NPs [78] | 基于EDS & NHS的戊二醛结合 | T =50℃, pH=5.0 |
| 14 | MnO2 NPs [46] | 戊二醛表面改性卵圆结合 | T =70℃, pH=5.0 |
此外,纳米颗粒对酶的稳定化还体现在提高酶的重复利用性和储存稳定性上。Tao等[72]利用Fe3O4NPs@SiO2固定纤维素酶,发现在50℃条件下,经固定的纤维素酶的半衰期是未经处理的纤维素酶的2倍,且在重复使用7个循环后,依然能保持最初活性的77%。Poorakbar等[81]制备了一种磁性介孔SiO2纳米颗粒用于纤维素酶的固定,经固定的纤维素酶在9 h后的活性能保持初始活性58%,热稳定性、pH稳定性和储存稳定性均得到提升。Abbaszadeh等[75]用铜负载的磁铁矿纳米颗粒稳定纤维素酶,发现经稳定后的纤维素酶展现出更好的稳定性,并且在循环使用5次后其活性依然能保持初始活性的73%,在4℃下保存8 d后,未经稳定和经稳定的纤维素酶的活性分别为初始活性的70%和84%。Manasa等[82]利用铁酸锌纳米颗粒(Zn x Fe3-x O4NPs)固定纤维素酶,使酶的活性增加,在同样的超声波辅助碱性预处理条件下纤维素酶水解的糖产量增加53%,并且固定化纤维素酶的活性在60℃下保持了3个循环。Hu等[71]制备了一种利用氨基功能化磁性二氧化硅纳米颗粒并研究其对漆酶的稳定化效果,经稳定化的漆酶在50℃下孵育2 h后活性能保持初始活性的98%,而未经处理的漆酶活性仅为初始活性的40%。将未经稳定和稳定后的漆酶在4℃下储存,18 d后未经稳定的漆酶完全失活,而稳定后的漆酶活性仍能保持初始活性的79.25%。
2.2 金属纳米颗粒提高氢化酶活性影响产氢的作用机理
利用纤维素水解产物的暗发酵产氢过程中只有33%的初始底物最终转化为氢气,而剩余67%的未利用底物最终转化成其他代谢物如乙酸、丁酸、乙醇、丁醇、丙酮等[83],H2产率低和底物转化率低仍是该方法的主要缺点[84],因此,研究者们将研究重点放在提高底物向氢的转化效率和微生物活性上,以通过改变微生物代谢的稳定性来提高产氢的速率和可持续性。
暗发酵生物制氢涉及多种微生物和多种酶的参与。在严格厌氧菌(如梭菌属)的产氢过程中,葡萄糖经糖酵解(EMP)途径生成丙酮酸,随后丙酮酸在丙酮酸脱氢酶的作用下脱氢,将电子转移给铁氧还蛋白,铁氧还蛋白再将电子传递给氢化酶,最终在氢化酶的作用下,H+获得电子形成H2。而在兼性厌氧菌(如肠杆菌属)中,丙酮酸在甲酸裂解酶的作用下形成甲酸和乙酰CoA,然后在甲酸氢裂解酶的作用下产生CO2和H2[85]。除丙酮酸外,葡萄糖经EMP途径还会产生大量的还原型辅酶(NADH)和H+。丙酮酸经不同代谢途径产生乙酸、丁酸、乙醇及乳酸等产物的过程中,NADH和H+被氧化成为氧化型辅酶(NAD+),保证NADH/NAD+平衡。但当NADH和H+消耗过程慢于形成过程时,必然会造成NADH和H+的不断积累。为了调控平衡,在氢化酶的作用下,NADH将电子转移给H+,从而产生H2。
在上述暗发酵产氢过程中,氢化酶是起核心作用的酶。氢化酶的活性位点以铁和镍为金属辅基,根据活性位点上存在的金属可将其分为两类:铁-铁氢化酶和铁-镍氢化酶[26]。铁和镍在酶活性位点上的存在表明这两种金属对暗发酵途径有显著影响。虽然铁-镍氢化酶广泛存在于微生物种群中,而铁-铁氢化酶仅在一些厌氧细菌和厌氧真核微生物中被发现[86],但是[Fe-Fe]氢化酶具有更高的产氢性能[87]。[Fe-Fe]氢化酶的活性中心由一个[4Fe-4S]簇和一个[2Fe-2S]簇组成。巴氏梭菌体内的[Fe-Fe]氢化酶结构如图5所示,灰色区域包含一个H-团簇,紫色区域包含[4Fe-4S]簇和[2Fe-2S]簇[88]。[Fe-S]在H-团簇与外部电子载体之间的电子转移中起到重要作用[89]。由于氢化酶的催化活性依赖于其活性位点上的金属团簇,因此加入金属纳米颗粒可以有效地影响暗发酵产氢的效率。金属纳米颗粒促进暗发酵产氢主要通过以下几个方面:一是消耗系统中的氧为厌氧菌提供厌氧环境[26, 90-91];二是金属纳米颗粒的表面效应和量子尺寸效应可以提高微生物体内电子转移速率;三是提高氢化酶和铁氧还蛋白的活性。以Fe0NPs为例[91](图6),在进入微生物体内后,当Fe0NPs在水相中暴露于氧气时通过以下反应被氧化[26, 92]:
图5
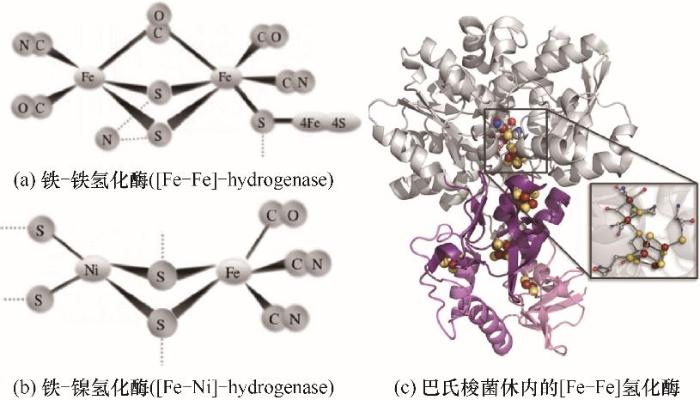
Fig.5 Chemical structure of the active site for hydrogenase[26, 88]
图6

图6 纳米零价铁金属颗粒在暗发酵产氢过程中的作用机理[91]
Fig.6 Mechanism of Fe0 NPs in dark fermentative hydrogen from lignocellulose[91]
这一反应可在不到1min内完成。消耗掉可用的氧气后,由于水的氧化还原电位比氧气低,Fe0NPs被水氧化,然后生成氢气作为反应的唯一产物:
由于Fe0/Fe2+的氧化还原电位低,上述反应在环境温度和压力下很容易发生。值得注意的是,铁颗粒尺寸从微米级减小到纳米级可以将上述反应的速率提高10000倍[92-93]。反应产生的Fe2+能够提高氢化酶和铁氧还蛋白的活性,因为铁元素是它们活性位点上的关键元素[89]。
金属纳米颗粒通过提高氢化酶的活性促进暗发酵产氢过程已经得到界内的认可,一些学者近年来利用铁、镍和其他金属纳米颗粒及其掺杂复合材料等来促进暗发酵产氢的研究总结见表2。Han等[60]研究了不同浓度的Fe2O3NPs对以丁酸梭菌为优势菌群的混合厌氧细菌培养系统在以蔗糖为底物的间歇反应器中介导的暗发酵生物制氢的影响,发现在最适温度35℃,pH=8.48,纳米颗粒的浓度为200 mg/L的条件下,最大产氢量达3.21 mol H2/(mol蔗糖),比对照组(添加量为0)的产氢量高32.64%。不同金属纳米颗粒的复合材料也有相应的研究,Beckers等[110]研究了包裹在多孔SiO2中的Fe x O y 、Pd、Ag、Cu复合纳米颗粒(FeNPs@SiO2,PdNPs@SiO2,AgNPs@SiO2,CuNPs@SiO2)对暗发酵厌氧丁酸梭菌产氢的影响,发现与对照组(不添加纳米颗粒)相比,复合纳米颗粒均对产氢有促进作用,其中FeNPs@SiO2纳米颗粒的作用最明显,氢气总产量提高了38%,平均比产氢速率从44.7 ml/h提高到61.8 ml/h。
表2 不同类型金属纳米材料在暗发酵生物制氢中的应用
Table 2
| 序号 | 微生物种类 | 基质 | 条件参数 | 纳米材料 | H2产量提高效果① |
|---|---|---|---|---|---|
| 1 | Enterobacter | straw | pH 7,37℃ | Fe0NPs | 提高73.1%[91] |
| 2 | Enterobacter cloacae DH-89 | glucose | pH 7,37℃ | FeNPs | 提高230%[94] |
| 3 | Clostridium pasteurianum | glucose | 35℃ | Fe2O3 NPs | 提高52.5%[80] |
| 4 | Clostridium butyricum | sucrose | pH 7,35℃ | α-Fe2O3 NPs | 提高32.64%[60] |
| 5 | Enterobacter aerogenes | glucose | pH 6.0,37℃ | γ- Fe2O3 NPs | 提高17%[24] |
| 6 | mixed culture bacteria | inorganic salt | pH 6,37℃ | iron oxide NPs | 提高81.4%[95] |
| 7 | heat pretreated sludge | sugarcane bagasse | pH 5.0,30℃ | Fe3O4 NPs | 提高69.6%[96] |
| 8 | anaerobic sludge | paper mill waste water | pH 7.5 | Fe3O4 NPs | 提高127.4%[97] |
| 9 | Parageobacillus thermoglucosidasius KCTC 33548 | glucose, starch | pH 6.5,55℃ | Fe3O4 NPs | 提高315%[98] |
| 10 | heat pretreated sludge | grass | pH 7,37℃ | Fe0 NPs / biochar | 提高89.8%[99] |
| 11 | anaerobic bacteria | glucose | pH 7,30℃ | Fe0 NPs / activated carbon | 提高50.2%[100] |
| 12 | Enterobacter aerogenes | glucose | pH 6.8,37℃ | Fe0 NPs /chitosan | 提高30%[29] |
| 13 | Clostridium pasteurianum | glucose | pH 7,35℃ | α-Fe2O3&TiO2 NPs | 提高24.9%[101] |
| 14 | anaerobic mixed bacteria | glucose | pH 7,37℃ | Fe2O3-Fe3O4 NPs /carbon | 提高33.7%[102] |
| 15 | Enterobacter aerogenes | fruit waste | pH 6.5,37℃ | Fe3O4 NPs /DSAC | 提高204.5%[103] |
| 16 | mixed culture bacteria | gelatinaceous wastewater | pH 6,35℃ | Fe3O4/graphene oxide | 提高41.9%[104] |
| 17 | Enterobacter aerogenes | glucose | pH 6,37℃ | ferric citrate NPs | 提高50.45%[105] |
| 18 | mesophilic bacteria | starch | pH 5.0~6.0,37℃ | Fe0 NPs, Ni0 NPs | 提高37%[2] |
| 19 | Clostridium butyricum | glucose, starch | pH 6.8,37℃ | Fe0 NPs&Ni0 NPs | 提高28%[106] |
| 20 | hydrogen-producing bacteria | anaerobic sludge | pH 5.0,37℃ | Fe2O3 NPs, NiO NPs | 分别提高24%和16%[107] |
| 21 | thermophilic mixed bacteria | glucose | pH 5.5,60℃ | α-Fe2O3 NPs, NiO NPs | 分别提高34.38%和5.47%[4] |
| 22 | mixed consortia | glucose | pH 5.6,35℃ | Ni NPs | 提高22.71%[108] |
| 23 | Clostridium butyricum | glucose | pH6.9,37℃,55℃ | NiFe2O4 NPs | 分别提高38.6%(37℃),28.3%(55℃)[30] |
| 24 | Bacillus anthracis | palm oil | pH 7,37℃ | NiO NPs, CoO NPs | 分别提高151%和167%[21] |
| 25 | Clostridium beijerinckii | rice mill wastewater | pH 7,37℃ | NiO NPs, CoO NPs | 分别提高109%和90.4%[109] |
| 26 | Clostridiumbutyricum | glucose | pH 7.6,30℃ | Fe NPs@SiO2, Pd NPs@SiO2, Ag NPs@SiO2, Cu NPs/SiO2 | 提高38%[110] |
| 27 | mixed consortia | glucose | pH 5.5,50℃ | ZnO NPs | 提高29%[111] |
| 28 | Clostridiumbutyricum | sucrose | pH 7.2,35℃ | Au NPs | 提高61.7%[38] |
| 29 | Enterobacter cloacae | glucose | pH 7,37℃ | Pd(Ⅱ) NPs | 在单一菌种和混合菌种培养条件下分别提高1.5%和9%[112] |
| 30 | mixed culture dominated by Clostridium species | glucose | pH 8.0~9.4,35℃ | Ag NPs | 提高67.3%[113] |
① 与不添加纳米材料的对照组比较。
Gadhe等[107]研究了Fe2O3NPs添加量对产氢量和比产氢速率的影响,随着添加量从0.5 mg/L提升到50 mg/L,产氢量提高了22%;当添加量为50 mg/L时,产氢量较对照组(添加量为0)提高了24%,比产氢速率提高了43%;而当添加量超过50 mg/L时,氢气产量和比产氢速率均出现了下降,这可能是由于高浓度Fe2O3下氧化自由基增加引起的氧化应激使氢化酶的功能结构发生变形所导致的[38, 60, 114]。在暗发酵生物制氢中,投加过高浓度的金属纳米颗粒可能会导致氢气产量下降,这一现象在很多研究中都有报道。图7总结了一些研究中暗发酵氢气产量与金属纳米颗粒投加浓度的关系,可以看出随着投加量增加,氢气产量均出现先增加后降低的趋势。Zhang等[102]利用Fe2O3/carbonNPs促进暗发酵生物制氢,发现纳米颗粒浓度为200 mg/L时氢气产量最高,当浓度达到400 mg/L时,氢气产量与对照组相比降低了5.5%,这可能是因为纳米颗粒在浓度过高时会通过氧化应激、细胞壁穿透和破损降低微生物的活性[36]。Rambabu等[103]发现当Fe3O4NPs浓度大于150 mg/L时,氢气产量开始下降,当浓度达到300 mg/L时,氢气产量低于对照组。高浓度的金属纳米颗粒会增大其穿过微生物细胞的浓度梯度,导致金属纳米颗粒扩散进入微生物细胞。这些穿透进入细胞的金属纳米颗粒会损害细胞器,不仅导致细胞中重要组分流失,还会对遗传物质造成损害[116]。纳米颗粒浓度过高还会导致氢化酶中Fe-S亚基上的L-半胱氨酸配体上的硫原子形成不可逆键,这种结合会通过二硫酸代酸盐桥联的破坏而导致酶活性位点损坏[117]。因此,保证合适的金属纳米颗粒投加浓度对提高暗发酵氢气产量尤为重要。
图7
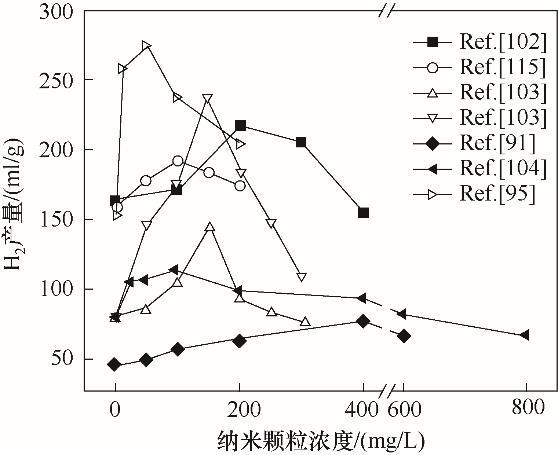
图7 金属纳米颗粒浓度与木质纤维素暗发酵氢气产量之间的关系[91, 95, 102-104, 115]
Fig.7 Relation between addition of MNPs and H2 production in dark fermentation from lignocellulose[91, 95, 102-104, 115]
Mullai等[108]研究镍纳米颗粒对暗发酵产氢的影响,发现在pH=5.6、温度30~35℃时,产氢量可提高21%,且镍纳米颗粒浓度为5.67 mg/L时,在最佳条件下可获得4400 ml的累积产氢量。Yang等[91]研究发现Fe0NPs可使产氢量和比产氢速率分别提高73.1%和128.3%,这是由于Fe0NPs加快了铁氧还蛋白和氢化酶之间的电子转移速率,从而增强了微生物的活性。Zhang等[30]比较了中温(37℃)和高温(55℃)下添加不同剂量的NiFe2O4NPs对微生物产氢的效果。37℃时添加量为100 mg/L和55℃时添加量为200 mg/L时,得到最高的H2产率分别为222 ml H2/(g葡糖糖)和130 ml H2/(g葡糖糖),较对照组分别提高38.6%和28.3%。这是由于NiFe2O4NPs经微生物的内吞作用释放的铁和镍有利于铁氧还蛋白和氢化酶的合成,增强了丁酸盐产氢途径,优化了微生物群落结构,增加了丁酸梭菌的丰度。
3 金属纳米颗粒对木质纤维素暗发酵产氢微生物的影响
3.1 金属纳米颗粒对暗发酵生物制氢过程中微生物细胞的影响
金属纳米颗粒促进暗发酵生物制氢还体现在其对微生物细胞的影响,研究关注主要包括微生物代谢途径、电子传递、氢化酶活性、胞外聚合物以及细胞的形貌变化。
暗发酵产氢往往伴随溶解性细胞代谢产物(SMPs)的生成,包括乙酸、丙酸、丁酸等挥发性脂肪酸(VFAs)及乙醇等。这些产物作为评价发酵性能的重要指标,研究者通过分析产生的SMPs来反映添加金属纳米颗粒对微生物代谢途径的影响。Cao等[118]研究了铁镍复合的碱基磁性纳米颗粒(AMNPs)对混合培养细菌在中温、高温条件下的SMPs,发现AMNPs在中温条件下能调控微生物的丁酸型发酵和乙酸型发酵途径,使体系中NADH/NAD+达到平衡;而在高温条件下,AMNPs可平衡微生物的乙酸型发酵和乙醇型发酵,且AMNSs的碱性能够对乙醇型发酵产生的有机酸起到缓冲作用。Cheng等[119]发现添加Fe3O4NPs可使产气肠杆菌(E. aerogenes ZJU1)暗发酵产氢的代谢途径从丁酸型发酵转变为乙酸型发酵,这是由于乙酰辅酶A转化为乙酸不消耗NADH,故增加了细胞内NADH的积累并强化了NADH产氢途径。Lin等[24]发现添加Fe2O3NPs使肠杆菌属细胞的SMPs中乙醇含量减少、乙酸含量增加,这说明Fe2O3NPs改变了肠杆菌的代谢途径,强化了乙酸型发酵的同时减弱了乙醇型发酵,从而提高了H2产量。
具有导电性的磁铁矿或金属铁氧化物具有促进种间电子传递(interspecies electron transfer, IET)的功能,IET又可分为介导型种间电子传递(MIET)和种间直接电子传递(DIET)[120]。在MIET机制中,电子通过可溶性介质(如甲酸盐、H2)传递[121-122],而DIET是一种更为高效的种间电子传递方式,微生物细胞通过细胞膜表面的导体(如纤毛)进行电子传递,不需要介质的参与[123]。金属纳米颗粒可通过聚集形成微生物细胞间的“非生物纳米导线”,弥补如细胞色素C、纤毛等生物导体的不足,促进种间直接电子传递和细胞膜内电子传递(图8)[120, 124-125]。Han等[60]通过透射电镜观察到了暗发酵制氢过程中Fe2O3NPs黏附在混合菌群细胞表面[图9(a)],这可能有助于细胞的固定,并增加其与基质接触的机会。此外,在暗发酵初期,混合菌群中的某些细菌可通过胞外呼吸的方式,将细胞内氧化有机物产生的电子跨膜传递到胞外电子受体表面,而附着在细菌表面的Fe2O3NPs可作为胞外呼吸的末端电子受体。并且由于部分铁氧化物具有良好的导电性,在胞外电子传递过程中可充当导电材料。异化铁还原菌是可进行胞外呼吸的典型代表微生物,能以含三价铁的铁氧化物作为外源末端电子受体,将三价铁还原为二价铁。Zhang等[30]在混合菌群暗发酵产氢过程中投加NiFe2O4NPs,发现虽然NiFe2O4NPs中铁元素多为三价铁形式,但系统液相中铁却以Fe2+形式存在,这表明NiFe2O4NPs中的铁可被异化铁还原菌作为电子受体利用,梭菌作为一种典型的发酵型异化铁还原菌在以葡萄糖为碳源的铁还原环境中起主导作用。金属纳米颗粒作为介导电子供体菌与电子受体菌之间的“桥梁”在种间电子传递过程中发挥作用。Lin等[24]通过扫描电镜观察发现,与未添加Fe2O3NPs的细胞相比,添加Fe2O3NPs的肠杆菌细胞表面出现更多的团聚体,这些团聚体是细胞表面蛋白与Fe2O3NPs响应产生的生物纳米导线(bacterial nanowire,BN)(图10),能促进葡萄糖进入细胞,同时也在细胞间的电子传递中起到重要作用。El-Naggar等[126]也证实了电子会沿着西瓦氏菌的生物纳米导线传递。
图8

图8 金属纳米颗粒在产氢和产甲烷过程中参与微生物种间电子传递[120]
Fig.8 MNPs involve in intracellular and extracellular electron transportation for H2 and CH4 production via IET interaction[120]
图9

图9 透射电镜下观察到的聚集在细菌表面的金属纳米颗粒[60, 119]
Fig.9 TEM images of MNPs stuck to the bacterial surfaces[60, 119]
图10

图10 扫描电镜下观察到的肠杆菌细胞表面蛋白与Fe2O3NPs响应产生的生物纳米导线[24]
Fig.10 SEM images of bacterial nanowire produced by response of surface protein of E. aerogenes cells and Fe2O3NPs[24]
金属纳米颗粒在暗发酵过程中通过溶解或经微生物侵蚀释放出金属离子,这些多价态金属离子(如铁离子)能够与细胞膜表面的蛋白受体发生作用,促进胞外电子转移。细胞外溶解的金属离子进入微生物体内能够促进胞内电子传递。Lin等[24]还发现Fe2O3NPs能穿过细胞膜进入细胞,在微生物代谢产生的VFAs的腐蚀下,逐渐释放Fe2+。铁作为重要的生命元素,参与微生物代谢活动中关键酶或蛋白质的组成(如氢化酶和铁氧还蛋白),因此金属纳米颗粒中溶解释放出的铁离子能对氢化酶或铁氧还蛋白的合成起到促进作用。Cao等[118]发现适量的AMNPs添加可提高混合菌群氢化酶的活性,其中添加100 mg/L AMNPs的系统中微生物氢化酶活性比对照组高28%,这可能是由于AMNPs受到氢化酶的活性位点的侵蚀,释放出了Fe2+并与细胞表面的氢化酶相互作用,促进电子传递。Cheng等[119]发现Fe3O4NPs投加量为200 mg/L时,E.aerogenes ZJU1细胞的NADH/NAD+比值、氢化酶活性和细胞内电子传递速率均得到提高。Fe3O4NPs聚集在E. aerogenes ZJU1细胞表面[图9(b)],与细胞膜上的氢化酶发生作用,加速氢化酶中的电子转移。同时,Fe3O4NPs释放的Fe2+对氢化酶的合成及其活性的提高起到了促进作用。此外,还认为Fe3O4NPs的表面效应、量子尺寸效应和优异的导电性能促进了胞内电子传递。由于氢化酶对氧化还原电位较为敏感,Fe3O4NPs还能通过调控NADH的水平降低氧化还原电位,从而提高氢化酶活性。Han等[60]发现随着暗发酵时间的延长,Fe2O3NPs的尺寸从50 nm逐渐减小至10 nm,同时系统中铁离子的浓度也不断增加。铁离子的缓慢释放可避免其浓度过高导致细胞损害。投加200 mg/L的Fe2O3NPs后,细菌细胞的形态相较对照实验组变得更加细长。
Cao等[118]发现暗发酵后AMNPs中的铁和镍大量聚集在微生物细胞表面,除了与细胞膜上的蛋白、酶发生反应,还能与胞外聚合物发生作用,使其中的酶释放进一步加速蛋白质和多糖的水解。Zhang等[30]通过三维荧光发现添加NiFe2O4NPs后细菌产生的胞外聚合物中腐殖酸类有机物的含量有所增加,这类有机物中的羟基和羧基可与金属离子螯合,增加金属离子的生物可利用性和迁移性。Cheng等[119]也发现投加Fe3O4NPs后细菌胞外聚合物中腐殖酸和黄腐酸类物质含量增加,这有利于细菌之间电子传递。胞外聚合物还能起到阻挡金属纳米颗粒进入细胞的作用,防止纳米颗粒过多地进入细胞内,造成细胞的损坏。Zhang等[30]观察发现,尽管细菌形成的胞外聚合物能作为屏障将大部分NiFe2O4NPs阻挡在细胞外,但依然有少量NiFe2O4NPs能够穿过细胞膜进入微生物体内并促进胞内电子传递。Zhao等[127]也通过实验证明一定量的CuONPs能够在不破坏细胞膜的情况下进入大肠杆菌细胞。
3.2 金属纳米颗粒对暗发酵生物制氢过程中微生物群落结构的影响
能够进行暗发酵产氢的微生物很多,主要包括:梭菌属(Clostridium sp.)、脱硫弧菌属(Desulfovibrio sp.)、埃希氏菌属(Escherichia sp.)、丁酸芽孢杆菌属(Trdiumbutyricum sp.)、柠檬酸细菌属(Citrobacter sp.)、克雷伯氏菌属(Klebsiella sp.)、肠杆菌属(Enterobacter sp.)、醋微菌属(Acetomicrobium sp.)、甲烷球菌属(Methanococcus sp.)等。在中温和高温条件下,梭菌是主要的产氢微生物,这使得梭菌成为暗发酵微生物群落中重点关注的对象[128-129]。研究者们经常采用接种污泥的混合菌群来进行暗发酵,这其中除了含有严格厌氧微生物外,还含有兼性厌氧菌(如肠杆菌)。兼性厌氧菌会消耗系统中的氧气,减少氧气对严格厌氧菌的限制,因此在暗发酵生物制氢中采用混合菌群可以获得更好的协同产氢效果[87]。然而混合菌群中的乳酸菌等会同产氢细菌争夺基质,降低产氢效果[130]。投加金属纳米颗粒能够改变暗发酵产氢系统中微生物的群落结构,使产氢细菌成为优势菌种,从而促进氢气产量的提高。
微生物群落结构变化会对系统的产氢性能产生显著影响。群感效应(quorum sensing,QS)是微生物群体、个体之间通过分泌、释放特定的信号分子来调控菌群的行为和功能,使其适应环境变化的信号通讯基质[131]。典型的QS信号分子有高丝氨酸内酯(AHL)、寡肽类化合物。虽然生物制氢是一个涉及多菌群的发酵过程,但是目前有关QS在生物制氢过程中影响微生物协同作用的研究却未有报道。微生物菌群为了能够在共同生存的环境中存活,形成了一种对抗QS的机制,称为群体猝灭效应(quorum quenching,QQ),这是一种有效干扰群体感应中关键过程、促使信号分子失效的过程[132]。在变形菌门、厚壁菌门和放线菌门中均存在QQ效应。这些细菌可以分泌群体效应猝灭酶(如AHL内酰胺酶)降解AHL信号分子[132-133]。Kumar等[134]报道了芽孢杆菌具有产氢性能,并且能够分泌AHL内酰胺酶。此外,很多金属离子和化学试剂会影响AHL内酰胺酶的活性,一定浓度的Na+、K+、Ca2+、Fe3+、Mn2+对AHL内酰胺酶的活性有正向作用[135-136]。金属纳米颗粒释放的Fe3+或许能够对暗发酵产氢过程中某些细菌的QQ起到促进效果,也可能强化系统中微生物群体的QS影响产氢效果,然而目前还没有相关的研究报道出现。
目前针对暗发酵产氢过程中微生物群落变化的研究主要是通过高通量测序观察微生物的相对丰度变化。Yang等[99]研究了铁纳米颗粒添加对暗发酵微生物群落的影响,发现相较于对照组,添加Fe0NPS、carbon/Fe0NPs样品的Simpson指数显著降低,Shannon指数显著升高,表明这两种添加剂显著提高了系统中微生物的多样性。此外,还可使肠杆菌属(Enterobacter sp.)和梭菌属(Clostridium sp.)的相对丰度存在显著差异。对照组、Fe0NPS和carbon/Fe0NPs的实验组中Enterobacter sp.分别占87.8%、52.8%和15.6%,Clostridium sp.分别占7.2%、40.3%和77.5%。Zhang等[100]研究了零价铁粉末-活性炭(ZVI-AC)强化生物制氢过程中微生物群落的变化,发现添加了ZVI-AC样品的Shannon指数(4.701)大于对照组。较高的物种多样性有利于维持微生物群落结构的稳定,微生物群落结构的变化主要源于ZVI的添加。在添加ZVI-AC的系统中,梭菌属(Clostridium sensu sticto)成为主要的微生物,比对照组高33%。在另一项研究中,Yang等[91]研究发现添加400 mg/L Fe0NPS的实验组中狭义梭菌属(菌株Clostridium sensu stricto1与Clostridium sensu stricto3)、肠杆菌属(Enterobacter sp.)分别占66.5%、20%,而对照组狭义梭菌属(Clostridium sensu stricto1)、肠杆菌属(Enterobacter sp.)和微杆菌属(Exiguobacterium sp.)分别占11.9%、64.4%和22.5%。微生物群落结构出现变化很可能是由于Fe0NPS使系统中的氧化还原电位降低,有利于严格厌氧菌的生长。在氢气发酵过程中,氧化还原电位是影响系统产氢性能的关键因素[137]。严格厌氧菌在氧化还原电位低于-200 mV的环境下表现出较好的活性,而向系统中添加了400 mg/L Fe0NPS后,系统的氧化还原电位从-133.6 mV降低至-273.3 mV,使优势菌属从肠杆菌属变为梭菌属。虽然肠杆菌属和梭菌属都能利用多种底物(如葡萄糖、蔗糖、半纤维素和纤维素)产氢,但梭菌属的产氢能力高于肠杆菌属,这是因为肠杆菌属只能通过甲酸分解途径产氢[理论产氢量为2 mol H2/(mol葡萄糖)],而梭菌属可通过丙酮酸分解途径和NADH途径产氢[理论产氢量为4 mol H2/(mol葡萄糖)]。
向暗发酵生物制氢系统中添加金属纳米颗粒也可能导致微生物多样性降低。Mostafa等[104]研究发现在暗发酵产氢系统中添加磁铁矿/氧化石墨烯纳米颗粒(MGONPs)可使样品中微生物多样性低于对照组,但梭菌属(Clostridium sp.)成为了优势菌种。这种微生物多样性的降低有利于产氢优势菌群的存活并提高产氢量,因为某些乳酸菌[如肠球菌(Enterococcus)]会与产氢细菌竞争可用底物,还会产生过氧化氢多肽抗生素进一步抑制产氢细菌的活性[99]。Zhang等[30]研究了NiFe2O4NPs在中温(37℃)和高温(55℃)条件下对嗜温菌和嗜热菌群落结构的影响。在投加NiFe2O4NPs后,嗜温菌和嗜热菌的微生物多样性均出现下降(Shannon指数分别下降了0.338和0.036),但厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和绿弯菌门(Chloroflexi)的相对丰度均增大。厚壁菌(Firmicutes)可以形成内生孢子以抵抗和适应恶劣的环境,而其他一些菌株在高温环境中会休克并且难以恢复。拟杆菌门(Bacteroidetes)和绿弯菌门(Chloroflexi)可以将复杂的有机物(如纤维素、蛋白质和果胶)转化为小分子物质。Elreedy等[111]研究了高温条件下铁、镍、锌纳米颗粒对微生物群落结构的影响。在添加α-Fe2O3NPs (200 mg/L)、NiONPs (20 mg/L) 和 ZnONPs(10 mg/L)的系统中,嗜热厌氧菌的相对丰度从对照组的9.0%分别下降至4.0%、4.0%和5.0%;然而其中梭菌属(Clostridium sp.)的相对丰度从10%分别增加至16%、18%和19%,最终也使产氢量得到提高。
4 总结与展望
将木质纤维素用作原料进行暗发酵生物制氢,不仅实现了氢气的生产,也对废物进行了利用,是极具潜力的生物制氢手段。但暗发酵本身存在效率低、氢气产量低的问题,木质纤维素中也含有大量难降解的木质素和半纤维素,因此该技术面临诸多问题和挑战。随着暗发酵生物制氢技术的发展,金属纳米颗粒作为辅助因子在木质纤维素暗发酵产氢中已经得到探索和发展,有望克服暗发酵技术的瓶颈。金属纳米颗粒在木质纤维素暗发酵生物制氢中的作用包括:①强化木质纤维素生物质的预处理;②对水解酶的固定化,提高酶的热稳定性和酸碱稳定性,从而提高酶对木质素和纤维素的水解;③提高氢化酶活性促进暗发酵产氢;④调控微生物细胞代谢途径和促进细胞电子传递;⑤改善暗发酵产氢体系中微生物群落结构实现多菌群的协同高效产氢。
金属纳米颗粒辅助木质纤维素生物制氢依然存在很多待解决的问题,如:①金属纳米颗粒应用于木质纤维素暗发酵生物制氢的机理还未得到充分的解释(如功能化金属纳米颗粒水解木质纤维素的机理、金属纳米颗粒的投加是否会对暗发酵产氢体系中微生物的群感效应和群体猝灭效应产生影响);②合适的金属纳米材料(金属种类、粒径大小)、基质类型、纳米颗粒投加浓度和酶固定化的最佳固定条件还需要进一步探索;③金属纳米颗粒的合成成本较高,如何降低其制备成本以及提高可重复利用性,使得纳米颗粒能够在工业化规模的生物制氢中得到应用;④如何实现金属纳米颗粒的分离与回收;⑤纳米颗粒的合成主要通过化学方法,容易对环境和人体造成危害。如何减少化学物质的使用,以降低纳米颗粒的毒性。
面对这些问题,一些有潜力的发展方向也值得被越来越多的研究者探索,如:①金属纳米颗粒的绿色合成。使用植物提取物、废弃物和微生物合成高稳定性的纳米材料,可减少化学试剂的使用并降低制备成本。②暗发酵的副产物(如挥发性脂肪酸)可用作光发酵生物制氢的底物,因此可将金属纳米颗粒应用于暗发酵与光发酵的联合生物制氢。
- GB/T 7714-2025与GB/T 7714-2015相比,变更了哪些,对期刊参考文献格式有什么影响?
- 别被这个老掉牙的报纸理论版投稿邮箱误导了!最新核实91个报纸理论版投稿邮箱通道,一次集齐
- 喜报!《中国博物馆》入选CSSCI扩展版来源期刊(最新CSSCI南大核心期刊目录2025-2026版)!新入选!
- 2025年中科院分区表已公布!Scientific Reports降至三区
- 国内核心期刊分级情况概览及说明!本篇适用人群:需要发南核、北核、CSCD、科核、AMI、SCD、RCCSE期刊的学者
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



