天然大分子对花色苷的负载研究进展
花色苷是自然界中广泛存在的一种类黄酮化合物,是构成植物果实、花瓣、茎、叶等组织颜色的主要水溶性色素。自然条件下,常见的花色苷大多都以糖苷的形式存在于植物体内,其母核为2-苯基苯并吡喃,糖配体为一分子或者多分子的鼠李糖、葡萄糖、芸香糖、半乳糖、木糖等。所以,花色苷的种类因母核上的基团不同而不同(表1)。研究表明,自然界中天然存在的花色苷种类达600多种;食源植物中含量较高的花色苷有:矢车菊素(cyanindin,Cy)、天竺葵素(pelargonidin,Pg)、锦葵色素(malvidin,Mv)、矮牵牛花色素(petunidin,Pt)、飞燕草色素(delphinidin,Dp)以及芍药色素(peonidin,Pn)[1]。目前,花色苷因其多种营养功能特性被广泛关注。研究发现,花色苷具有优异的抗氧化活性,其消除游离自由基的能力是L-抗坏血酸的20倍,是维生素E的50倍,可保护人体免受自由基的伤害,有效延缓人体衰老[2]。另外,花色苷还具有降低血糖[3]、抑制脂质过氧化[4]、保护视力[5]、预防肿瘤[6]、抗心血管疾病[7]等多种生理活性。可见,作为一种安全、可食用且有一定保健功能的天然色素,花色苷在医药、食品、化妆品、保健品等行业中具有广泛的应用前景。
花色苷因含有多个活泼的酚羟基,结构稳定性较差,易出现分子重排和降解,所以在食品加工过程中易损失,如在热处理、pH变化、氧化剂、金属离子、酶等作用下降解,从而失去活性。此外,花色苷因结构特性,还表现出脂溶性差、亲水性强的性质,使其在亲脂体系中的应用涉及较少。在体内消化过程中,由于脂溶性差,不易透过磷脂双分子层被细胞吸收,使得花色苷的生物利用度也不高[8]。以上诸多因素都限制了花色苷在医药、食品等领域的使用。由此可见,提升花色苷结构稳定性,有利于其更好地发挥生理活性。
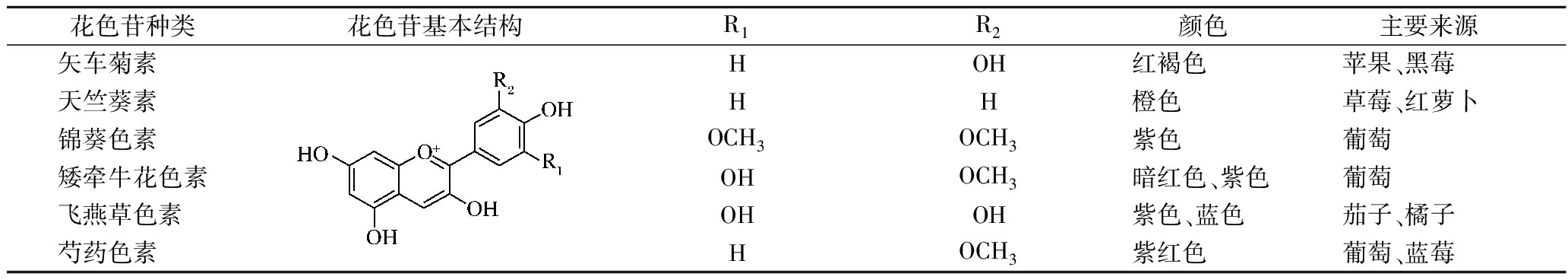
表1 花色苷基本结构与常见种类
Table 1 Basic structure and common species of anthocyanin
为改善花色苷结构稳定性,众多研究者通过适宜的方法对花色苷分子进行修饰,力争在不破坏其生理活性的条件下提高稳定性。迄今为止,花色苷结构稳定性提升方法主要分为两大类,结构修饰和大分子负载。大分子负载是基于花色苷和大分子之间以氢键、疏水作用、静电作用等次级键结合,即不会影响花色苷天然结构,又不会产生新的可能具有潜在危害的物质,因而成为花色苷稳定性提升的主要手段和研究热点。基于以上研究现状,本文系统综述天然大分子对花色苷负载的相关研究进展,对负载体系及其构建技术进行了归纳,以期为花色苷稳定性以及生物利用度的提升提供参考依据。
1 天然大分子对花色苷的负载机制
天然大分子是源于植物、动物及微生物的高分子类物质,是自然界广泛存在的一种可再生资源。近年来,被广泛应用于花色苷负载的天然大分子主要有蛋白质、糖类、脂类等。以天然大分子为基质,通过适宜的技术构建出不同类型的载体,可实现花色苷的高效负载。但在各类体系中,不同大分子基质与花色苷的相互作用机理不同。
1.1 蛋白质对花色苷的负载作用
蛋白质是一种具有高级空间结构的聚集体,其多肽链中含有多种氨基酸。蛋白质来源十分广泛,价格低廉,不仅具有食用安全性和高的生物相容性,而且营养价值极高。蛋白质上的氨基酸残基可通过疏水、静电、范德华力、氢键等作用形成多种作用位点,与花色苷分子不同基团非共价结合,从而表现出较强的亲和性,其结合机理如图1所示。蛋白质氨基酸残基上的羧基、氨基可与花色苷分子上的羟基形成氢键,酪氨酸、苯丙氨酸等残基上的苯环可与花色苷分子苯环形成疏水作用,而花色苷母核2-苯基苯并吡喃阳离子可与氨基酸残基上的羧基等负电基团以静电作用力结合。另外,各基团如果足够靠近,均可形成范德华力,进而稳定花色苷结构[9-10]。而且,蛋白质空间结构具有一定柔性,花色苷的加入使其结构发生变化,从而将花色苷分子固定在蛋白质特定的空间结构内,起到保护花色苷结构稳定而免受外界环境及加工条件影响的作用,还可能改善其生理活性[11-12]。
另外,蛋白质含有人体所需的多种氨基酸,在体内易被吸收,具有较高的营养价值,在保护花色苷结构稳定的同时还能补充机体所需氨基酸。由此可见,蛋白质因其氨基酸种类的多元化和广泛的来源、较高的营养价值以及低廉的成本,成为花色苷载体首选基质之一。
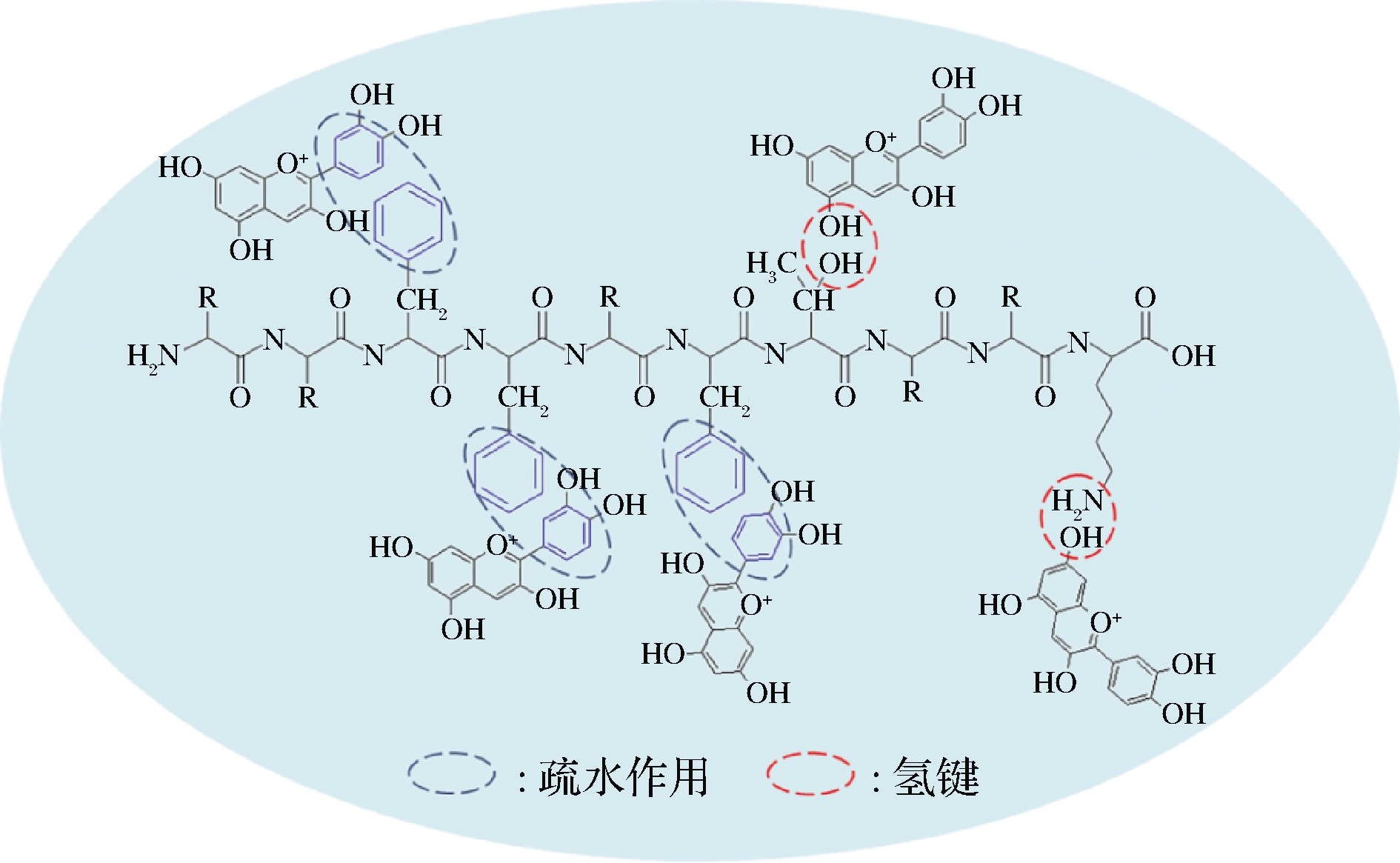
图1 蛋白质与花色苷的作用机理
Fig.1 Interaction mechanisms between protein and anthocyanin 注:多肽链中的R表示氨基酸的不同侧链基团
1.1.1 蛋白质与花色苷的作用机理
(1)植物源蛋白
用于负载花色苷的植物蛋白主要有大豆分离蛋白(Soy protein isolate,SPI)、小麦蛋白、花生分离蛋白、黑豆蛋白等。不同来源的蛋白质与不同花色苷分子的作用机理具有差异。研究表明,麦醇溶蛋白与矢车菊素-3-O-葡萄糖苷以范德华力、氢键相结合,其结合位点更接近色氨酸残基附近,而麦谷蛋白与矢车菊素-3-O-葡萄糖苷以疏水作用为主要结合力,其结合位点更接近酪氨酸残基附近;二者均形成了物质的量比约为1∶1的静态复合产物[9]。大豆分离蛋白与黑米花青素通过疏水作用结合,且结合位点数接近1[13]。SPI中提取的11S、7S球蛋白与矢车菊素-3-葡萄糖苷均以疏水作用结合[10]。由此可见,不同来源蛋白质与同一花色苷分子的结合作用可能不同,其原因在于不同蛋白质具有不同的空间结构。花色苷分子主要结合于暴露在多肽链外侧且对花色苷具有较高亲和力的残基上,这就要求该残基所处位置位阻小,结构柔韧性强,可直接负载花色苷或通过结构改变使花色苷高效负载。由于花色苷母核空间结构较大,因此花色苷分子更易于以疏水作用结合于蛋白质疏水区域。
(2)动物源蛋白
用于负载花色苷的动物源蛋白质主要为乳源蛋白质,如牛血清白蛋白、酪蛋白、乳清蛋白等。虽然乳蛋白来源相同,但因其结构各具特点,与花色苷的结合作用存在差异,如表2所示。牛血清白蛋白与锦葵色素-3-半乳糖苷的主要作用力为静电引力[14]。α-酪蛋白与氯化锦葵色素-3-O-葡萄糖苷结合作用以范德华力和氢键为主,结合过程放出热量且自发进行;而β-酪蛋白与氯化锦葵色素-3-O-葡萄糖苷以疏水作用结合,结合过程自发进行但吸收热量[11]。乳清蛋白、酪蛋白混合物可通过疏水作用力和氢键与紫薯花色苷相互作用形成复合物,并且酪蛋白与紫薯花色苷的亲和力较乳清蛋白强[15]。
综上所述,动物源蛋白质与花色苷的结合作用因蛋白质结构不同而具有差异。虽然结合作用不同,但是不同来源蛋白质对花色苷的亲和力均较高,结合常数多大于103。蛋白质与花色苷的结合作用强弱不仅与蛋白质结构有关,而且与花色苷结构有关。如,牛血清白蛋白与蓝莓花色苷通过静电作用结合,而其与黑米花色苷的结合作用为范德华力和氢键。即使结合作用存在差异,但各类蛋白质与各类花色苷分子间的结合机理主要为静态结合,即形成稳定的非共价复合物。
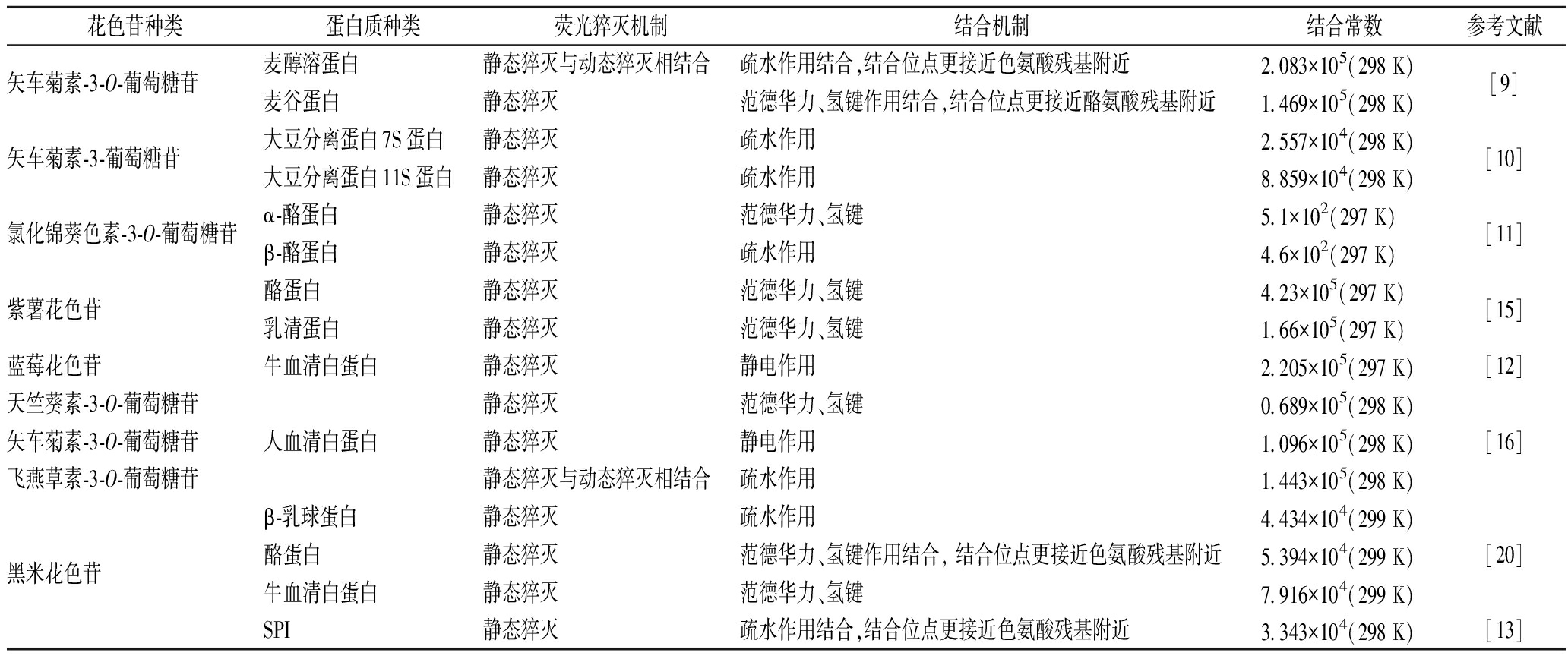
表2 蛋白质负载花色苷机理及其结合常数
Table 2 Loading mechanism and binding constants between protein and anthocyanin
1.1.2 蛋白质对花色苷稳定性的影响
由于蛋白质与花色苷分子间形成非共价作用,可保护花色苷结构稳定,缓解其在不利环境下的降解。例如,氯化锦葵色素-3-O-葡萄糖苷与α-酪蛋白、β-酪蛋白结合后,热稳定性、氧化稳定性以及光稳定性显著提升[11]。牛血清白蛋白负载的蓝莓花色苷分别在光照、蔗糖+光照、维生素C+光照的条件下都表现出较好的稳定性[14]。蛋白质对花色苷的结合作用、结合位点不同,结合后蛋白质构象变化不同,因此对花色苷分子稳定性提升效果不同。如,蚕蛹蛋白负载后的矢车菊素-3-O-葡萄糖苷,在热处理条件下的降解速率常数由原来单体花色苷的0.010 7减小为0.002 7,半衰期由64.81 min提高到261.99 min[17]。WU等[18]研究发现,以酵母甘露蛋白作为载体对花色苷进行负载后,在80 ℃以及126 ℃的条件下加热30 min,复合物中花色苷的颜色稳定性相较于单体花色苷提升了4~5倍。
1.1.3 蛋白质对花色苷生物活性的影响
花色苷分子中的部分基团与蛋白质特定氨基酸残基非共价结合,不仅影响其结构稳定性,而且使其生物活性受到影响。经蛋白质负载后,花色苷生物活性变化程度与载体蛋白质来源、结合作用、蛋白质构象变化程度等因素有关。研究表明,以SPI作为载体对葡萄籽原花青素(grape seed procyanidins,GSP)进行负载,发现在贮藏初期,游离GSP溶液的抗氧化性强于SPI-GSP复合物溶液,且包埋率越高,复合物抗氧化活性越弱;贮藏5 d后,游离GSP溶液的抗氧化活性显著降低,而SPI-GSP复合物抗氧化活性显著高于游离GSP溶液,其本质在于SPI负载抑制了GSP的降解[19]。β-乳球蛋白与黑米花色苷形成的复合物对DPPH自由基清除能力相较于未负载黑米花色苷提高了13.16%[20]。
综上所述,以蛋白质作为载体对花色苷进行负载,可有效降低花色苷因光、热、氧化以及pH等多种不利因素导致的降解,显著提升花色苷的生物利用度。不同的载体蛋白对花色苷的生物活性会产生一定的协同或拮抗作用,但在不利于花色苷稳定存在的条件下,载体蛋白都可以有效保护其生物活性。
1.2 多糖对花色苷的负载作用
多糖是由单糖通过糖苷键连接形成的一类天然大分子物质,因具有优越的功能特性、制备工艺简单、价格低廉等优点被广泛用于食品工业。多糖结构中存在的羟基可与花色苷分子通过氢键作用结合,残基上连接的羧基离子可与花色苷烊盐通过静电相互作用结合。此外,多糖还可与花色苷母核结构中的苯环以疏水作用或π-π堆积结合,且二者间产生的氢键可以更好地稳定该堆积作用[21-22]。在不同pH条件下,多糖基质的净电荷以及电荷分布不同,且花色苷分子也呈现不同的电性,例如:在强酸性环境中,花色苷主要以带正电荷的烊盐离子形式存在,而在弱酸性环境中负电荷形式则更为普遍。因此,调节多糖基质的pH可以实现与花色苷分子通过不同作用力结合,从而实现以多糖作为基质对花色苷分子的有效负载。
1.2.1 多糖与花色苷的作用机理
多糖作为天然大分子的一种,也被广泛应用于花色苷的负载。多糖对花色苷的负载能力受到其结构和pH的影响。由表3可以看出,不同pH下,多糖所带净电荷不同,其结构不同,对花色苷的结合机理不同。研究发现,蓝莓果胶对花色苷的结合率与pH有关,当pH为3.0时,花色苷的负载率最高,pH为4.0时最低,且当pH从4.0变化到更强酸性时,蓝莓果胶与花色苷之间的静电相互作用减小、疏水作用增加[23]。蓝莓果胶与花色苷的结合机制主要为果胶游离羧基与花色苷烊盐离子间的相互作用以及花色苷的堆积效应[21]。崔灵敏等[24]还通过等温滴定量热反应证明了芒果果胶与莲原花青素的结合机制主要为氢键驱动的放热反应。综上所述,多糖对花色苷的负载机理和蛋白质类似,都依赖于大分子链上的活性基团,而这些基团的带电性与pH有关。因此,可通过调控体系pH达到调控多糖与花色苷的结合作用。
表3 多糖负载花色苷机理
Table 3 Loading mechanism of polysaccharide for anthocyanin

1.2.2 多糖对花色苷稳定性的影响
经多糖负载后,花色苷非共价结合于多糖链上,再经过其他大分子的保护或适宜的构建,形成包覆物,将花色苷包裹在大分子内部,从而显著提升花色苷稳定性。因此,不同性质多糖的复配物是常用的花色苷载体。麦日艳谷·亚生等[27]研究了果胶、海藻酸钠、壳聚糖、黄原胶以及羧甲基纤维素钠对黑莓果汁中花色苷稳定性的影响,发现低浓度(0.05%~0.1%)的羧甲基纤维素钠或者黄原胶负载提高了黑莓果汁中花色苷的稳定性,且当加入载体的浓度低于0.1%时,可有效地减缓花色苷的降解。在低pH条件下,硫酸软骨素、κ-卡拉胶复合凝胶体系对蓝莓花色苷具有保护作用[22]。
1.2.3 多糖对花色苷生物活性的影响
多糖不但可以有效提升花色苷稳定性,对其生物活性也会产生一定影响。另外,大多数天然多糖本身具有一定的抑菌、抗氧化等功效,其与花色苷的复合物表现出比单一物质优异的生物活性。有研究表明,果胶-原花青素复合物对金黄色葡萄球菌有显著的抑制作用,且抑制作用强于游离原花青素和纯果胶[24]。LIN等[21]还证明了花色苷与蓝莓果胶复合后,其结肠微生物菌群发酵的生物利用度提高,更加有利于促进结肠健康。
1.3 脂质对花色苷的负载作用
1.3.1 脂质对花色苷的负载能力
脂类物质是由脂肪酸和醇组成的天然大分子及其衍生物的总称,是人体需要的重要营养素之一。脂类物质经过适宜的构建后,对花色苷的负载不仅可以提高花色苷稳定性,而且还可在其疏水空腔中同时结合疏水性物质,实现亲水分子和疏水分子的同时负载,进一步提升目标分子的稳定性及生理活性。研究证明,原花青素-维生素E复合磷脂前体脂质体的协同抗氧化性显著,且复合物稳定性良好,对原花青素的包封率为86%[28]。胆固醇、大豆卵磷脂复合脂质体对紫甘薯花青素的包埋率为76.61%[29]。负载姜黄素的磷脂脂质体同时负载原花青素,包封率为66.96%[30]。
1.3.2 脂质对花色苷稳定性的影响
负载花色苷常用的脂质有卵磷脂、胆固醇等,研究者通常将脂质构建成脂质体,实现对花色苷的负载。脂质体对花色苷的稳定性影响显著,纳米脂质体中的原花青素在25 ℃黑暗条件下保存16 d的保留率为85.60%[31]。此外,纳米脂质体的包封有效提高了原花青素的热、pH、光照稳定性。王子敏等[28]将制备的原花青素-维生素E复合前体脂质体进行了稳定性实验,研究发现,将50 mL原花青素-维生素E复合前体脂质体与质量浓度为1 g/L的原花青素溶液在室温条件下保存35 d、60 d后,复合物中原花青素保留率分别比未负载原花青素高30.3%、15.5%。常影等[32]还发现,经过壳聚糖修饰的纳米脂质体可有效减缓花色苷在金属离子、热、光等条件下的降解。
1.3.3 脂质对花色苷生物活性的影响
脂质体对花色苷生物活性也具有一定的影响。SUN等[33]研究表明,脂质体花色苷的DPPH自由基清除能力高于单一未负载花色苷,且在相同浓度下,脂质体花色苷的细胞抗氧化活性显著高于未负载花色苷。胡兴佳等[30]研究发现,姜黄素-原花青素复合磷脂脂质体的抗氧化性显著强于未负载姜黄素和原花青素抗氧化性的物理叠加。
2 天然大分子负载体系及其构建技术
选择适宜的大分子基质,经过物理或化学的方法使花色苷与大分子基质相互作用,形成复合物,进而通过干燥、凝胶化、微胶囊化、乳化等手段形成终产物,在保护花色苷自身稳定性的同时还可对其进行缓释,提高生物利用度。负载体系的基质、构建技术、载体类型是影响负载率的主要因素。常见的负载体系有乳液、微胶囊、脂质体、凝胶等。不同体系构建方法不同,负载能力也有所不同(表4)。
表4 不同负载体系构建工艺
Table 4 Construction process of different loading systems
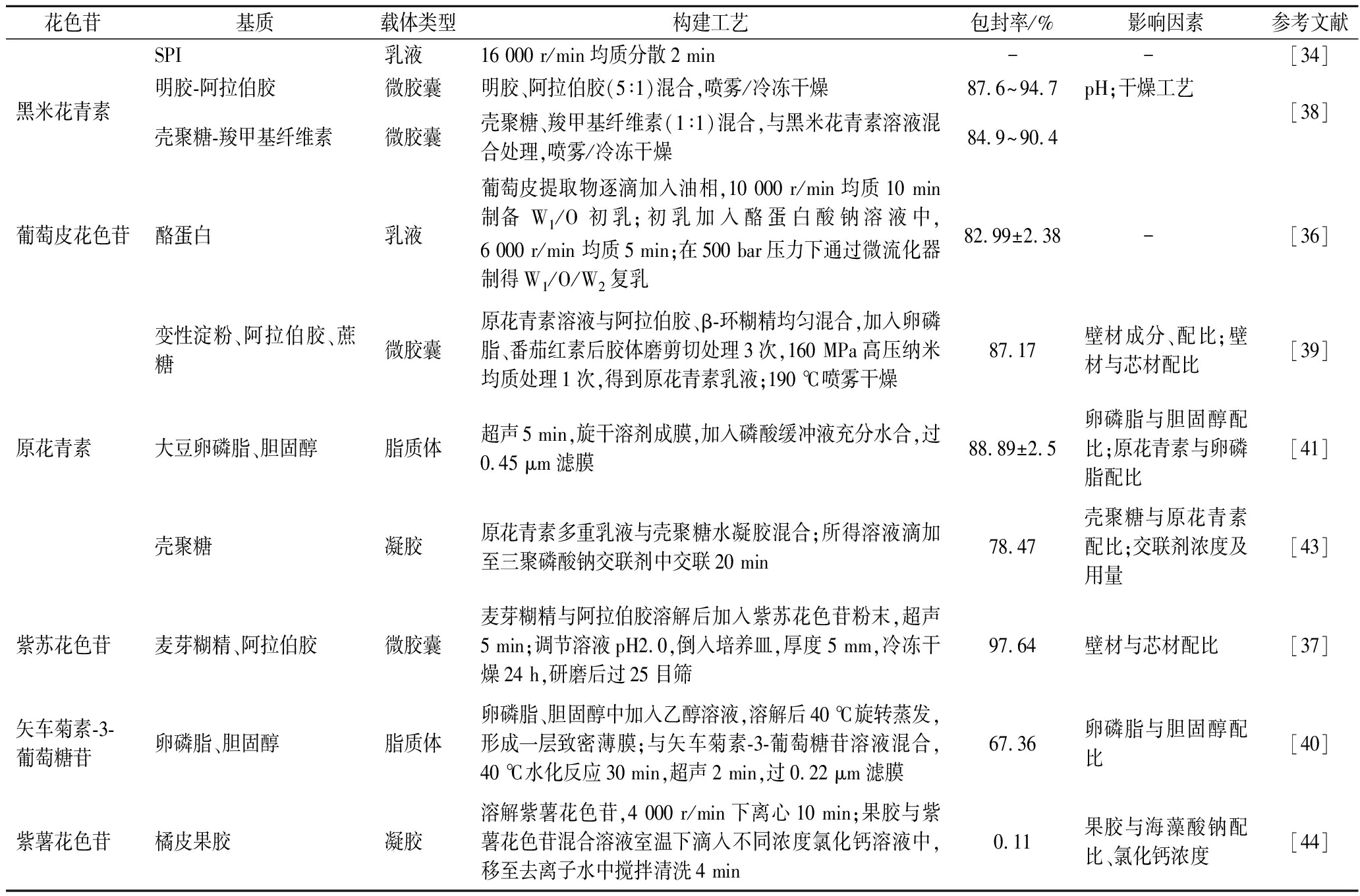
注:-表示未测定
2.1 乳液
乳液是指通过机械搅拌将1种或者多种液体分散于另一种与其不相溶的液体中,从而形成具有一定稳定性、抗聚集、抗絮凝的分散体系。单一乳液按其分散形式可分为水包油(O/W)乳液、油包水(W/O)乳液。以天然大分子为基质对花色苷负载后,在其乳化过程中天然大分子不但可以形成稳定的乳液,而且可以通过静电、疏水、范德华力、氢键等作用力与花色苷结合。但乳液在受到物理、化学作用后会发生破乳,出现分层现象。因此,选择适宜的两亲性聚合物与表面活性剂是乳液稳定的关键。在乳液技术中常以表面活性高、乳化性能好的蛋白质基质作为首选(例如:酪蛋白、大豆蛋白等),表面活性较差的则需要添加表面活性剂辅助乳化。
近年来,众多研究者将乳液体系应用于花色苷分子的负载,用于提高花色苷的稳定性。SPI-花青素复合乳液表现出较好的稳定性和抗氧化性[34]。与普通乳液相比,Pickering乳液的稳定性更高,更有利于保护花色苷。JU等[35]以SPI与花色苷为原料制备了稳定性和抗氧化性俱佳的SPI-ACN复合Pickering乳液,进一步提高了花色苷的稳定性。有学者在单一乳液的基础上制备了多重乳液,即将油包水(W1/O)初级乳液进一步分散于连续水相中,获得了W1/O/W2型多重乳液,该乳液对花色苷分子包埋率高达(82.99±2.38)%,且表现出较好的稳定性,证实了多重乳液在负载能力方面的优势[36]。
2.2 微胶囊
微胶囊技术是以一定的壁材,将固态、液态、气态等物质包裹在核壳结构内部,形成微米级别的胶囊型物质的技术(图2)。壁材外壳可以有效防止小分子与外界不利因素的接触,从而保证其稳定性,同时也可通过壁垒作用起到对芯材的缓释作用,降低芯材毒性,提高生物利用度。微胶囊技术因制备过程简单、包埋率高、成本低的优势受到研究者的青睐。天然大分子基质对花色苷负载后,通过不同的干燥技术制备形成微胶囊。多糖基质因其成本低、来源广等特点被广泛用作微胶囊壁材。对于壁材的选择可以是单一多糖,例如以硫酸软骨素作为壁材,通过冷冻干燥技术获得的微胶囊对蓝莓花色苷的包埋率为73.2%[37];也可以是多种多糖基质联合使用,例如明胶-阿拉伯胶和壳聚糖-羧甲基纤维素壁材,其对黑米花青素的包埋率高达84.9%~94.7%[38]。以蔗糖、阿拉伯胶、变性淀粉为壁材制备的微胶囊对原花青素的包埋效率可达90.58%[39]。可见,微胶囊对花色苷的包埋效果较好,而多种壁材联合使用有利于提高包埋率。
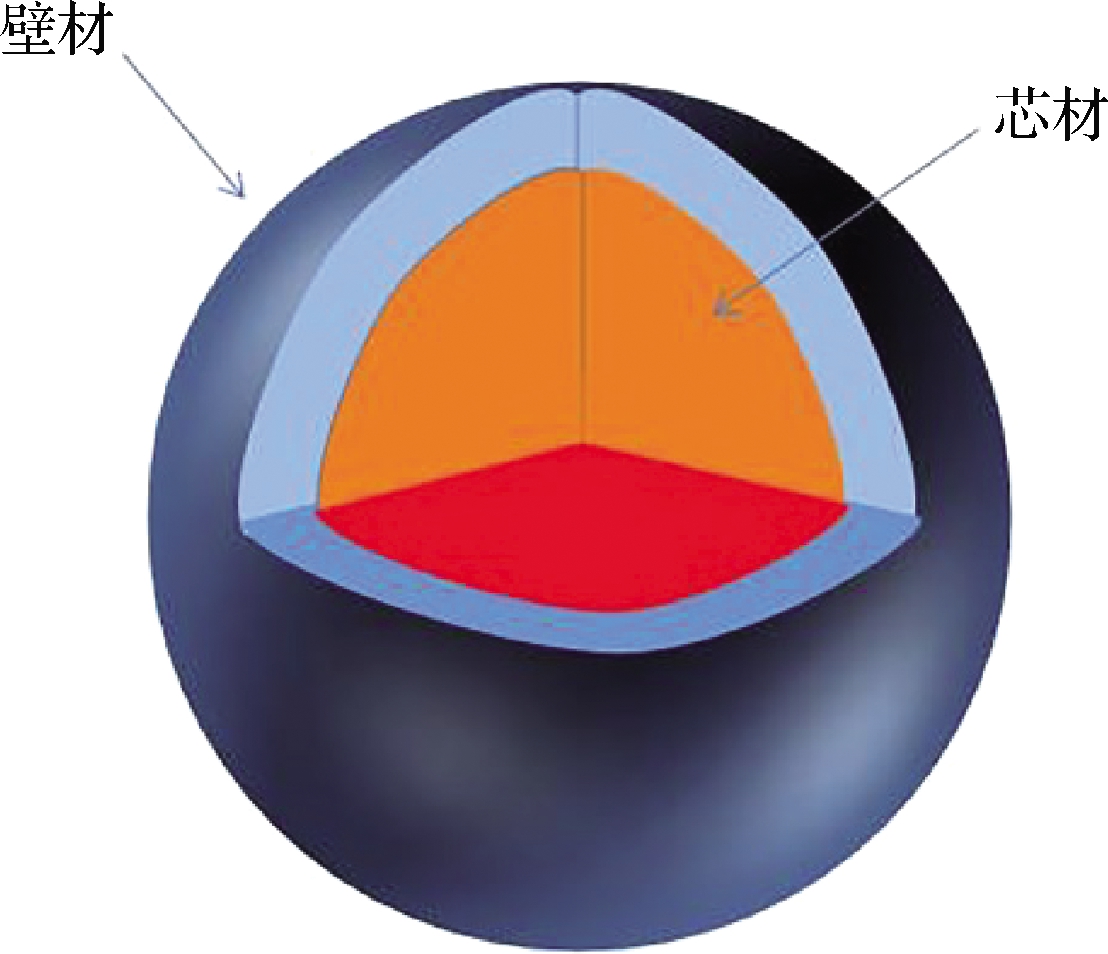
图2 微胶囊结构示意图
Fig.2 Structure diagram of microcapsule
2.3 脂质体
脂质体是以胆固醇、磷脂等作为膜材料形成的一类类似生物膜结构的闭合型囊泡物质[40],因其粒径较小、易于吸收且具有一定靶向性等优点,被广泛应用于花色苷分子的负载。水溶性的花色苷分子被包埋于脂质体的内水相,不但可以保护花色苷分子免受外界不利因素的影响,并且可以有效弥补花色苷分子脂溶性差的缺点。脂质体的制备工艺主要有注入法、薄膜分散法、超声波分散法、逆相蒸发法、冷冻干燥法等。上述制备方法各有优缺点,其中逆相蒸发法制备的单层脂质体具有较大的水性空间,更适合对水溶性物质的包埋。在制备过程中,通常将多种方法联合使用,以提高包埋率。胡博等通过逆相蒸发法将大豆卵磷脂、胆固醇与原花青素混合,制备了近似球状的原花青素脂质体,其粒径介于185 nm~1.29 μm,对原花青素的包埋率达(88.89±2.5)%[41]。SUN等[33]采用乙醇注射法与超声法结合制备了花青素纳米脂质体,花青素的包封率为(91.1±1.7)%。
2.4 凝胶
凝胶是指通过一定作用使胶体粒子或高分子相互连接形成一种具有空间网状结构的软固体分散体系[42](图3)。该体系可以是水溶性体系,也可以是乳液体系,常用材料为天然大分子,具有稳定性好、包封率高的特点。凝胶载体通常是将花色苷分子固定在凝胶网状结构内部,因此,网络结构越密集、网络内部分子与花色苷分子作用力越强,对花色苷分子的负载能力和保护效果越明显。凝胶化过程中可采用单一天然大分子基质,也可采用复合基质,通过基质间相互作用产生更加致密的网络结构,形成稳定性高的凝胶。常用凝胶基质为多糖和蛋白质。吴晓琼等[43]以壳聚糖水凝胶为原料制备的多重乳液水凝胶球对原花青素的包封率为78.47%,在25 ℃避光保存下具有较好的稳定性。钙离子诱导下的海藻酸钠与果胶复合凝胶对紫薯花色苷的包封率为1.10 mg/mL,并且凝胶的包封作用有效缓解了胃液对紫薯花色苷的降解[44]。

图3 凝胶负载机理
Fig.3 Mechanism of gel loading system
3 展望
花色苷因其天然的来源和功能的多样性,受到消费者的青睐。然而,花色苷结构稳定性差,易出现分子重排和降解,所以在加工过程中易损失。因此,提升花色苷稳定性是扩大其应用范围的前提。众多研究表明,天然大分子基质经过适宜的构建,可形成优良的负载体系,以保护花色苷结构稳定,有效避免花色苷因热、氧化、光等因素引起的降解。另外,负载基质还可对花色苷起到控制性释放作用,有效提升其生物利用率。
花色苷负载基质及负载体系多种多样,不同基质和不同体系各有优点。因此,基质的选择、复合,以及负载体系的构建技术仍需不断发展,且需综合考虑工艺和原料成本,才能进一步推动产业化。另外,现有研究对负载体系的构建和性能评价均在实验室环境中进行,其大规模生产时的包封率、产业化产品与实验室产品的差异等并未得到系统而深入的论证;花色苷与负载体系形成的复合物在实际加工过程中可能遭遇酸、热和光等协同作用,其稳定性评价仍需深入探讨。而且,现有研究中负载体系对花色苷的缓释效果及复合物活性评价多基于体外模拟胃肠环境,而生物体内环境复杂,消化系统包括多种物质和丰富的酶系、微生物,实际机体内负载体系对花色苷的控释效果、花色苷的生物利用度与体外模拟差异较大。因此,有必要对负载产物开展相关动物实验研究。
由此可见,花色苷负载及递送研究仍需深入开展,并不断创新,才能高效、科学、系统地指导相关成果产业化。
- GB/T 7714-2025与GB/T 7714-2015相比,变更了哪些,对期刊参考文献格式有什么影响?
- 别被这个老掉牙的报纸理论版投稿邮箱误导了!最新核实91个报纸理论版投稿邮箱通道,一次集齐
- 喜报!《中国博物馆》入选CSSCI扩展版来源期刊(最新CSSCI南大核心期刊目录2025-2026版)!新入选!
- 2025年中科院分区表已公布!Scientific Reports降至三区
- 国内核心期刊分级情况概览及说明!本篇适用人群:需要发南核、北核、CSCD、科核、AMI、SCD、RCCSE期刊的学者
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



