酿酒黄水对希瓦氏菌和假单胞菌抑菌机理的研究
黄水为棕黄色黏稠液体,由于其颜色棕黄故称之为黄水或黄浆水[1]。浓香型白酒生产过程中,酶与酵母将酒醅中的淀粉转化为酒精,同时生成CO2。该过程中微生物代谢的水分以及酒醅原有水分逐渐溶解酒醅中的有机酸、香味前体物等物质,最终沉积形成酿酒黄水。黄水中包括大量有机酸,其中乙酸、乳酸、丙酸、丁酸等含量较高。此外,黄水还含有酯、醇、醛等挥发性物质以及氨基酸等成分。目前,回窖、养窖以及人工窖泥是常规处理方式,但无法根本解决黄水的环境污染问题[2]。
新鲜鱼类具有高水分和高蛋白的特点[3],在储存和运输过程中易发生微生物的腐败,水产品中最常见的致腐菌包括希瓦氏菌、明亮发光杆菌、乳酸菌和假单胞菌。张雯等[3]从腐败的大黄鱼鱼肉中分离得到希瓦氏菌和假单胞菌,确定海水鱼的优势腐败菌为希瓦氏菌。郭全友等[4]研究也认为养殖大黄鱼中的优势腐败菌为希瓦氏菌。此外,苏红等[5]与张新林等[6]研究发现红鳍东方鲀与三文鱼中的优势腐败菌为假单胞菌。综上,在有氧冷藏条件下,希瓦氏菌为多数海洋鱼类的优势腐败菌,假单胞菌为多数淡水鱼类的优势腐败菌[7]。
鉴于此,本研究以希瓦氏菌和假单胞菌为研究对象,采用酿酒黄水作为生物保鲜剂,通过抑菌圈法、二倍稀释法表征酿酒黄水对希瓦氏菌和假单胞菌生长的影响,同时测定2种致腐菌的生长曲线、菌体细胞膜的通透性、磷酸酶(alkline phosphatase,AKP)活性等指标,并辅以扫描电子显微镜(scanning electron microscope,SEM)观察黄水处理前后2种菌体的微观形貌变化,来探索酿酒黄水对鱼类主要致腐菌生长的影响及其作用机制。
1 材料与方法
1.1 材料设备与培养基
希瓦氏菌,天津大学赠予;假单胞菌(CICC 21620),中国工业微生物菌种保藏管理中心;酿酒黄水,贵州茅台酒厂;酵母浸粉、蛋白胨、氯化钠、琼脂粉,北京索莱宝生物有限公司;碱性磷酸酶试剂盒,上海酶联生物科技有限公司。
台式扫描电镜(Pro),飞纳;AMR-100/100T酶标仪,奥盛仪器;XPS荧光酶标仪,Gemini。
LB培养基(g/L):酵母浸粉5,胰蛋白胨10,氯化钠10;固体培养基另外补充琼脂粉20。
1.2 实验方法
1.2.1 制备菌悬液
斜面菌种接种于5 mL的LB液体培养基中,30 ℃培养24 h,以2%接种量接种后二次培养8 h,7 000 r/min离心5 min,弃上清液,菌泥稀释至1×106 CFU/mL,备用。
1.2.2 抑菌圈的测定
参照SHARMA等[8]的方法并稍作修改。菌悬液以1‰的接种量接种至55 ℃的半固体培养基中,混匀,倒入牛津杯中,待半固体凝固后,拔出牛津杯,每小孔加入5 μL相应的液体,30 ℃培养24 h,游标卡尺测量抑菌圈直径,实验重复3次。
1.2.3 最低抑菌浓度(minimum inhibitory concentration,MIC)的测定
参照AL-ADHAM等[9]的方法并稍作修改。采用试管二倍梯度稀释法:每次试验使用9支试管,每支试管中先加入5.0 mL的LB液体培养基,121 ℃灭菌20 min,编号1~9。8号为阳性CK,只加菌液,9为阴性CK,只加酿酒黄水。1~7号试管,其中1号加入5 mL酿酒黄水,混匀后取5 mL加入2号试管,以此类推按1∶2至1∶128稀释,为使终液量都等于5 mL,7号和9号试管均弃5.0 mL培养基。1~8号试管按照2%的接种量接种,9号接种2%灭菌生理盐水,将希瓦氏菌和假单胞菌都放在30 ℃的恒温培养箱中培养24 h,观察结果。当阳性CK出现浑浊,而阴性CK呈现透明,实验结果有效,观察处理组的澄清情况,并进行记录。
1.2.4 致腐菌生长曲线的测定
参照杨昆等[10]的研究方法并稍作修改。处理组加入酿酒黄水并使其终浓度为MIC,37 ℃培养24 h,酶标仪测定OD600 nm值,前12 h每隔2 h 测定1次,之后12 h测定1次,实验重复3次,以培养时间为横坐标,OD600 nm的平均值为纵坐标,绘制生长曲线。
1.2.5 致腐菌核酸含量的测定
即4′,6-二脒基-2-苯基吲哚(DAPI),能够与核酸结合发出荧光,且与核酸量呈正比。因此,使用荧光酶标仪可测得胞内和胞外核酸总量[11]。
参照缪玉佳等[12]的研究方法。按照2%的接种量,将2 mL培养至对数期的菌离心处理(4 500 r/min,15 min),并用无菌水洗涤3次。用相应MIC浓度的黄水稀释致腐菌,30 ℃培养。取培养0、3、6、9、12、24 h的菌液各0.5 mL,加入等体积DAPI染色液,振荡培育10 min,用荧光酶标仪在DNA(364 nm)和RNA(400 nm)的激发波长下分别测定荧光强度,实验重复3次,以无菌水悬浮的菌体作为CK组。
1.2.6 致腐菌紫外吸收物质的测定
参照AL-ADHAM等[9]的研究方法并稍作修改。按照2%的接种量,将生长对数期的菌离心处理(4 500 r/min,15 min),并用无菌水洗涤3次。处理组:用相应MIC的黄水稀释致腐菌;阳性CK组:用等体积无菌水把菌体混匀,并加入Triton×100破裂菌体。阴性CK组:用等体积无菌水把菌体混匀。3组均30 ℃培养,分别于0、5 h取上清液,酶标仪测定。
1.2.7 致腐菌AKP酶活力的测定
洗涤对数期菌体,分别用离心前等体积的0.5MIC、1MIC、2MIC的黄水混匀菌泥,30 ℃培养,间隔4 h取样,4 500 r/min离心10 min,弃菌泥,留上清液,以试剂盒检测AKP酶活力。
1.2.8 致腐菌形态的观察
参照赵丽[13]的方法并稍作修改。向处于对数期的菌液加入MIC的酿酒黄水,充分混匀,培养6 h。取2 mL菌悬液,8 000 r/min,4 ℃离心5 min,弃上清液,用无菌水漂洗2次,离心收集菌泥,使用台式扫描电子显微镜观察用酿酒黄水处理过的菌体的微观结构。
1.3 统计学处理
实验重复3次,用SPSS统计软件进行数据分析,结果以(x±s)表示,实验数据采用单因素方差分析和t检验,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 酿酒黄水对2种致腐菌抑菌圈直径的影响
酿酒黄水对希瓦氏菌和假单胞菌都具有一定的抑制作用,对希瓦氏菌的抑菌圈为(16.44±0.61)mm,对假单胞菌的抑菌圈直径为(17.86±0.98)mm,说明黄水对于2个菌株均有较明显抑制生长的作用,后续实验可以继续开展。
2.2 酿酒黄水对2种致腐菌MIC的影响
由表1可看出,对于海水鱼主要致腐菌希瓦氏菌而言,在5号对应的体积分数3.13%条件下,菌株无法生长,但在6号对应体积分数1.56%的条件下,菌株即可导致培养基混浊,因此黄水对希瓦氏菌的最低抑菌浓度为3.13%。同理,假单胞菌的最低抑菌浓度是1.56%。后文以MIC代表2个致腐菌的最低抑菌浓度。
表1 黄水对希瓦氏菌和假单胞菌的MIC
Table 1 Minimum inhibitory concentration of yellow water against Shewanella and Pseudomonas
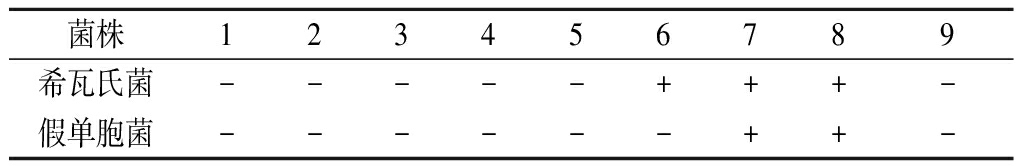
注:“+”代表浑浊;“-”代表澄清;数字1~7分别代表50%、25%、12.5%、6.25%、3.13%、1.56%、0.78%的黄水浓度;8代表阳性CK,仅加菌液;9代表阴性CK,仅加酿酒黄水
2.3 酿酒黄水对致腐菌生长曲线的影响
由图1-a可知,希瓦氏菌CK组8 h进入稳定期,前8 h的OD均值可达0.056 OD/h,第8 h OD值为0.47,0.5MIC处理时,前8 h的OD均值仅为 0.028 OD/h,第8 h OD值为0.23,低于CK组正常生长希瓦氏菌48.9%。相对而言,当希瓦氏菌处于1MIC和2MIC黄水环境下,生物量不增加,说明3.13%的黄水浓度可以有效抑制希瓦氏菌的生长。
由图1-b可知,假单胞菌CK组也在8 h左右进入稳定期,前8 h的OD均值为0.056 OD/h,第8 h为0.47,然而在0.5MIC黄水处理时,前8 h的OD均值为0.011 OD/h,第8 h为0.09,仅达到CK组的19.1%,说明1.56%的黄水浓度可以有效抑制假单胞菌的生长。
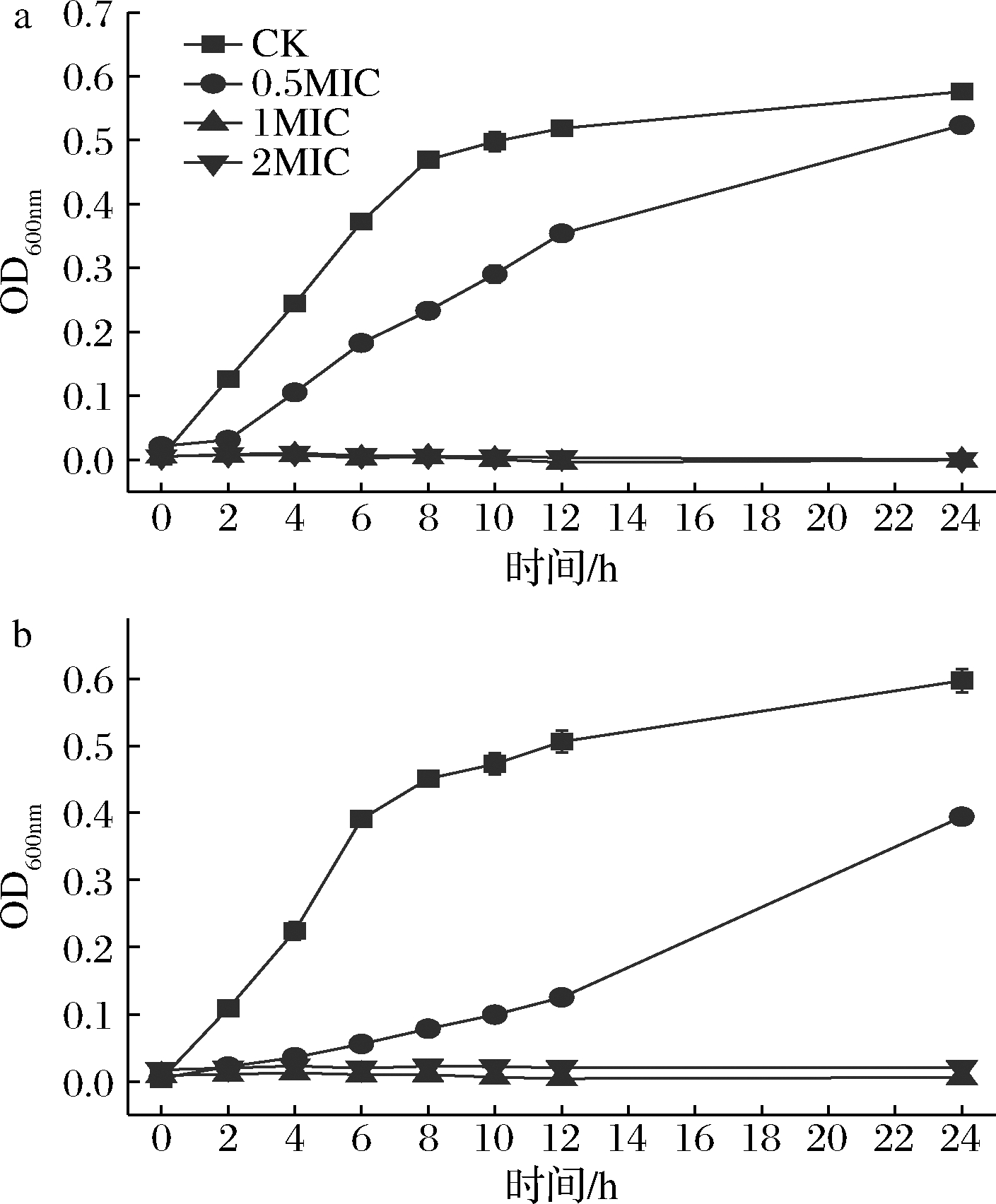
a-希瓦氏菌;b-假单胞菌
图1 酿酒黄水对生长曲线的影响
Fig.1 Effect of yellow water on the growth curve
2.4 酿酒黄水对致腐菌核酸含量的影响
由图2-a可知,希瓦氏菌CK组的DNA、RNA在8 h荧光强度最高,之后下降,这和图1-a的生长曲线相吻合,即生长曲线在8 h到达稳定期之后开始衰减,但是处理组DNA和RNA的荧光强度在6 h达到顶峰之后迅速衰减,DNA最大值55.3 RFU,仅是CK组最高值的64.9%。此外,处理组的DNA平均荧光强度为42.8 RFU,仅为CK组平均荧光强度的58.8%;RNA平均荧光强度仅为CK组的69.9%。
由图2-b可知,假单胞菌CK组DNA和RNA荧光强度最高值出现在12 h(分别为97.3 RFU与209.3 RFU)。相比之下,处理组DNA含量在第12 h仅有59.4 RFU,是CK组的61%,处理组的RNA含量在12 h仅有125.1 RFU,是CK组的59.7%。同时,处理组的DNA平均荧光强度为50.7 RFU,仅为CK组的61.5%,RNA平均荧光强度仅为CK组的54.5%。
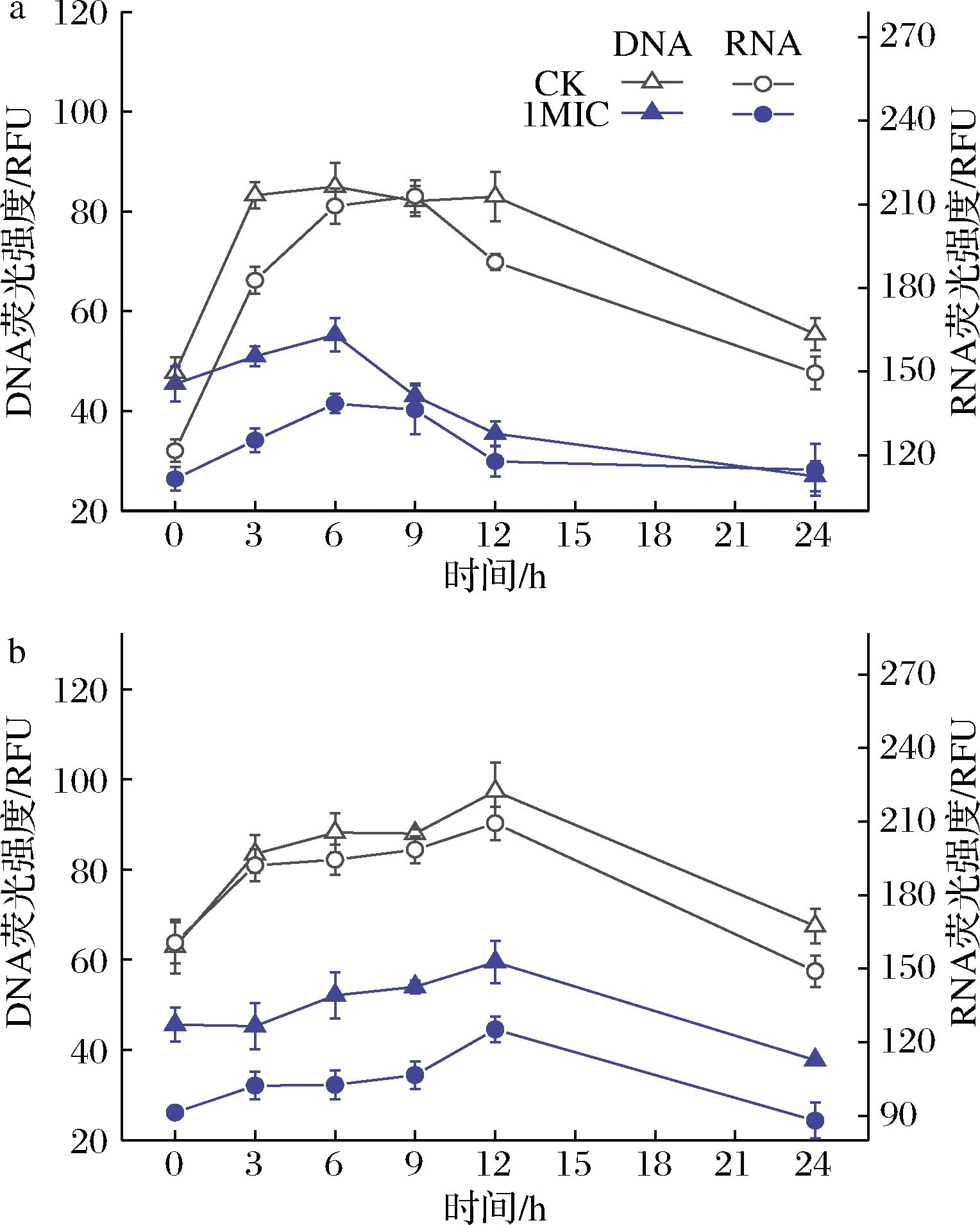
a-希瓦氏菌;b-假单胞菌
图2 酿酒黄水对DNA和RNA含量的影响
Fig.2 Effect of yellow water on synthesis of DNA and RNA
可见,黄水对于希瓦氏菌和假单胞菌的生长起到了非常明显的抑制作用,且与菌体刚接触时便能够起效。雷燕等[14]认为小分子的有机酸可以透过致腐菌的细胞壁,进入其细胞内解离出H+,H+能干扰细菌DNA和RNA的合成[15-16],从而抑制致腐菌的生长。研究发现黄水中酸的质量浓度可达19.64 g/L,因此处理组的核酸合成速度骤降可能与黄水中酸类物质解离出H+影响其合成有关。
2.5 酿酒黄水对致腐菌紫外吸收物质的影响
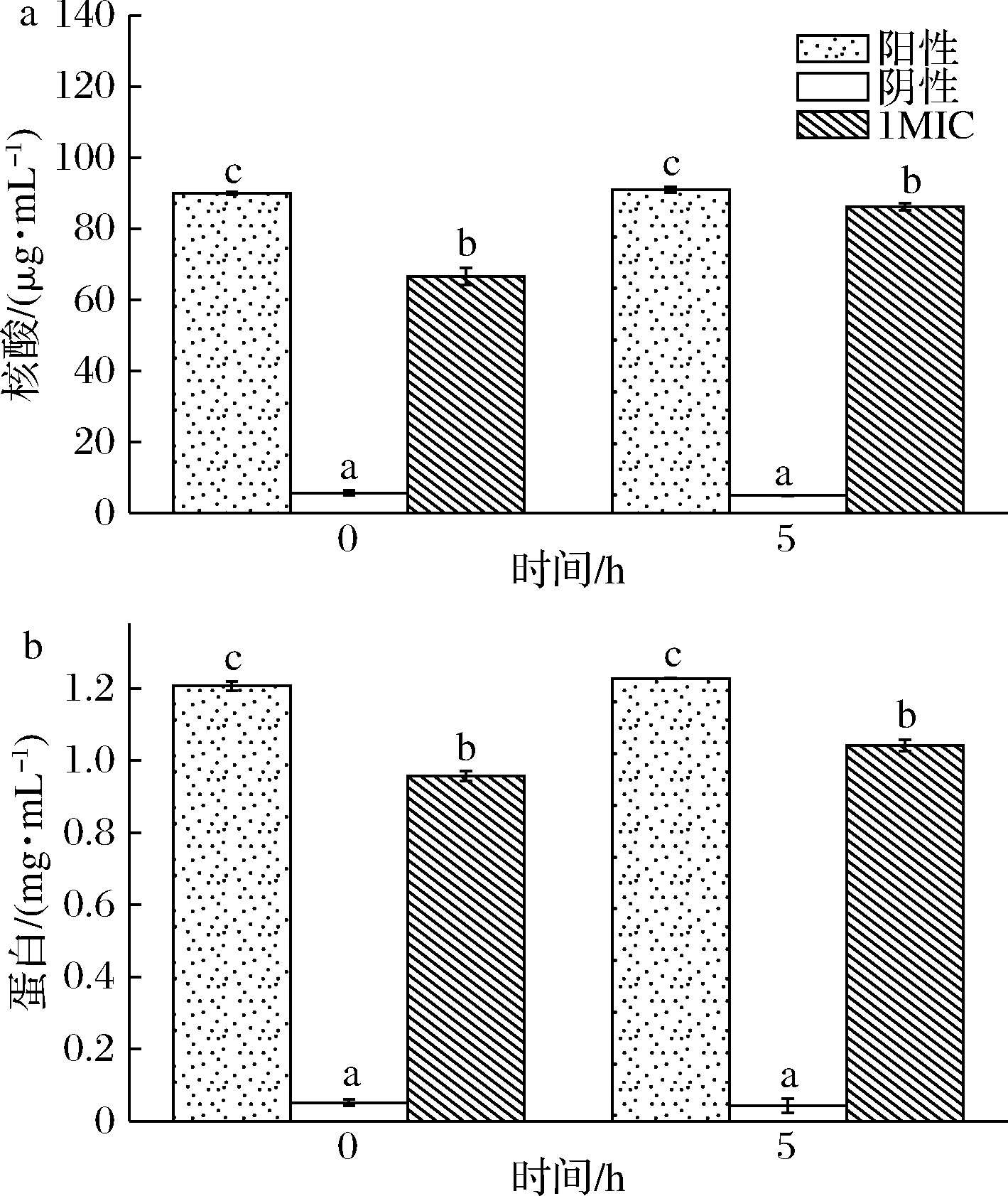
由图3可见,在使用Triton×100完全破碎菌体的阳性CK组中,希瓦氏菌的蛋白质及核酸的量,在0 h分别为1.06 mg/mL、90.7 μg/mL,在5 h分别达到1.02 mg/mL、92.4 μg/mL;阴性CK组中,希瓦氏菌的蛋白质及核酸的量,0 h分别为0.02 mg/mL与4.7 μg/mL,5 h分别为0.04 mg/mL与7.6 μg/mL。值得注意的是,1MIC黄水处理组,0 h时希瓦氏菌的蛋白含量是阴性CK组的3.33倍,随着处理时间延长,5 h时提高到21.5倍。与此相似,1MIC黄水处理组,0 h时希瓦氏菌核酸含量为阴性CK的4.57倍,处理时间延长至5 h,该数值增长到8.19倍。可见随着时间的延长,1MIC黄水处理组核酸与蛋白释放量均显著提高,证明黄水对于细胞膜具有破坏性的作用。
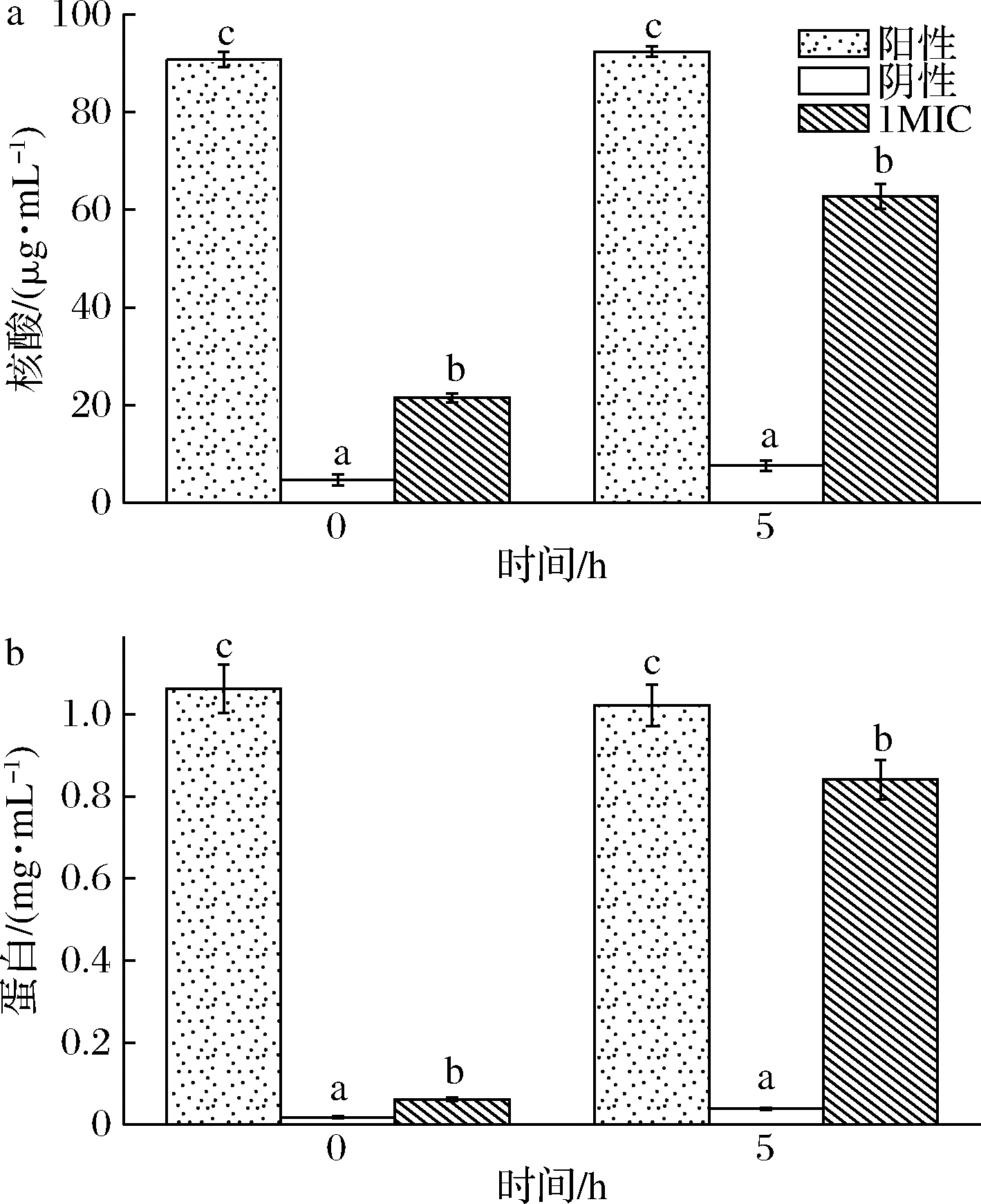
a-核酸;b-蛋白质
图3 酿酒黄水对希瓦氏菌核酸和蛋白质含量的影响
Fig.3 Effect of yellow water on the content of Shewanella
注:不同字母表示实验组间存在显著性差异(P<0.05)(下同)
同样,由图4可见,在阳性CK组中,假单胞菌的蛋白质及核酸的量,在0 h分别为1.21 mg/mL与89.9 μg/mL,5 h时可达到1.22 mg/mL与90.9 μg/mL;在不经过黄水和Triton×100处理的阴性CK组中,假单胞菌的蛋白质及核酸含量,在0 h分别为0.05 mg/mL、5.61 μg/mL,5 h分别达到0.05 mg/mL、4.94 μg/mL。值得注意的是,起始阶段,处理组与阴性CK组的蛋白质释放量比值为18.8∶1,处理5 h后为24.2∶1;尽管比值提高,但提升幅度并没有希瓦氏菌明显。对于核酸而言,1MIC处理组与阴性CK组相比,在0 h倍数差能达到11.7倍,处理5 h后倍数差为15.2倍,可见黄水对于假单胞菌细胞膜的影响起速快且更为明显,并且效果稳定度较好。
a-核酸;b-蛋白质
图4 酿酒黄水对假单胞菌核酸和蛋白质含量的影响
Fig.4 Effect of yellow water on the content of Pseudomonas
盛杰等[17]研究发现,酿酒黄水会通过抑制芽胞杆菌核酸与蛋白的合成,从而达到抑制其生长。BAJPAI 等[18]的研究表明,核酸和蛋白是细胞内重要的大分子物质,正常状态下不能透过细胞膜,但是当菌体细胞膜通透性增加时,会从细胞内泄露,因为在260 nm处核酸[19-21]有强吸收,因此可检测菌悬液的OD值来反应核酸含量的变化,可得到细胞膜是否完整的结果。LONG等[22]的研究也表明,核酸、蛋白质等生物大分子是细胞的重要组成结构,大肠杆菌细胞膜被破坏时,核酸、蛋白质等大分子物质就会从细胞内泄露。周倩倩等[23]研究发现,抑菌物质丁香酚与希瓦氏菌和假单胞菌接触后细胞膜通透性增加,使得核酸和蛋白质从细胞内泄露。这些现象与本研究结果相符。
2.6 酿酒黄水对致腐菌细胞壁通透性的影响
碱性磷酸酶存在于细胞壁、细胞膜之间,当细胞壁或膜破坏后,碱性磷酸酶会泄露。如果检测到胞外碱性磷酸酶活性上升,就反应了该细胞壁通透性增加。为了进一步探究黄水对于2种鱼类致腐菌可能的损伤机理,测定了2种致腐菌的AKP活性。由图5-a可见,CK组的希瓦氏菌8 h进入稳定期之后,由于菌体死亡量增大,AKP的酶活性上升速度加快,0.5MIC处理组与CK组相似。但在1MIC和2MIC处理条件下,2组AKP的酶活力随时间延长上升速度加快,平均可达8.11及8.59 mmol/(L·h)且加快速度及最终酶活力与黄水浓度呈正比,其中2MIC处理组中,希瓦氏菌的AKP酶活力在12 h内由34.4 mmol/L上升了3.9倍,达到了137.5 mmol/L,显著高于CK组的100.6 mmol/L(P<0.05)。
由图5-b可见,对假单胞菌8 h进入稳定期之后,AKP的酶活力同样上升速度加快。12 h时,0.5MIC处理组比CK组的酶活力高1.35倍,1MIC处理组比CK组的酶活力高1.53倍,2MIC处理组比CK组的酶活力高1.94倍。可知最终的AKP活力与酿酒黄水的浓度呈正比。这些结果表明细胞壁的通透性显著增加,意味着细菌细胞壁的完整性已被破坏。细胞壁具有固定细胞形态、提高细胞机械强度、避免渗透压等外力对细胞造成损伤的能力,失去细胞壁的保护,细菌很快就会死亡。因此,酿酒黄水能够通过破坏细菌细胞壁来提高其抗菌活性。HSOUNA等[24]认为酸类物质会导致细胞壁中脂多糖[25]的降解,导致细胞壁的外膜结构被破坏。经检测黄水中含有大量有机酸,因此推测有机酸会作用于2种致腐菌的细胞壁,导致其破损,从而使胞外AKP活力上升。
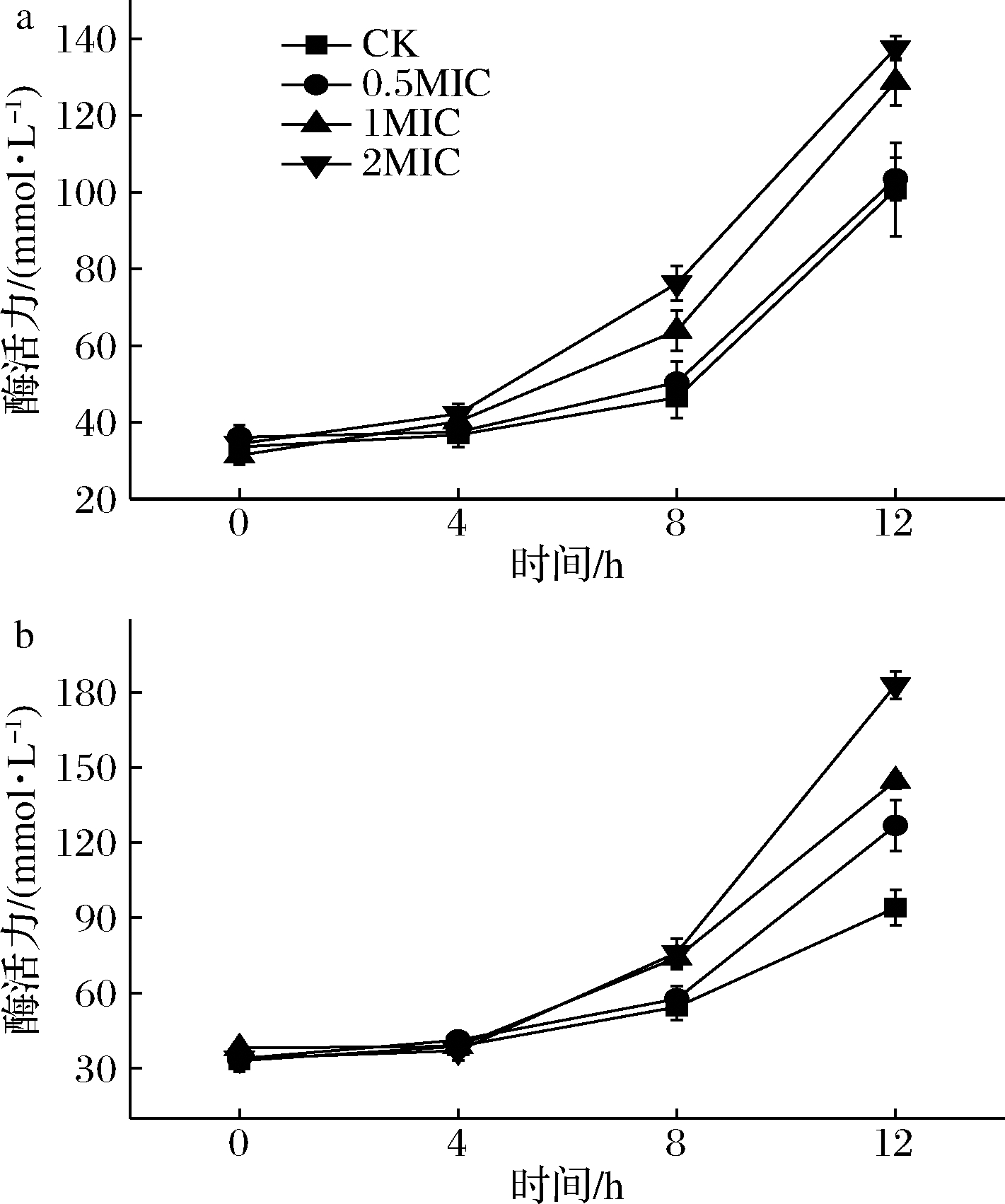
a-希瓦氏菌;b-假单胞菌
图5 酿酒黄水对AKP活力的影响
Fig.5 Effects of yellow water on AKP activity
2.7 酿酒黄水对致腐菌形貌的影响
图6与图7为黄水处理前后希瓦氏菌和假单胞菌电镜图。由图6-a与图7-a可见,正常的希瓦氏菌和假单胞菌大小为0.2~0.3 μm,杆状,个体独立,表面光滑、均匀。处理组经MIC黄水处理后希瓦氏菌和假单胞菌(图6-b与图7-b)表面出现凹凸不平,有的甚至出现凹陷与空洞,说明MIC浓度的黄水影响了希瓦氏菌和假单胞菌的细胞膜完整性,这一现象解释了AKP酶活力的实验结果。

a-正常形态菌;b-酿酒黄水1MIC处理
图6 希瓦氏菌电镜图
Fig.6 SEM images of Shewanella

a-正常形态菌;b-酿酒黄水1MIC处理
图7 假单胞菌电镜图
Fig.7 SEM images of Pseudomonas
HSOUNA等[24]认为酸类物质会导致革兰氏阴性菌细胞壁中脂多糖的降解,破坏细胞壁中的外膜结构。经检测黄水中含有丰富的有机酸,因此2个致腐菌在黄水的处理下呈现出细胞壁凹陷的现象很可能与此原因有关。
3 结论
3.13%与1.56%的酿酒黄水可以有效抑制希瓦氏菌与假单胞菌的生长。酿酒黄水破坏希瓦氏菌与假单胞菌的细胞膜透性与完整性,导致胞内蛋白质与核酸泄露,AKP活力上升,影响细菌正常的代谢过程,最终使菌体死亡。前期实验发现,酿酒黄水中所含的乳酸、庚酸、己酸、戊酸、柠檬酸等成分能够明显影响希瓦氏菌和假单胞菌生物量的增长,因此推测酸类物质为酿酒黄水的有效抑菌成分,本实验结果为酿酒黄水用于鱼类保鲜做了初步的理论铺垫。
- GB/T 7714-2025与GB/T 7714-2015相比,变更了哪些,对期刊参考文献格式有什么影响?
- 别被这个老掉牙的报纸理论版投稿邮箱误导了!最新核实91个报纸理论版投稿邮箱通道,一次集齐
- 喜报!《中国博物馆》入选CSSCI扩展版来源期刊(最新CSSCI南大核心期刊目录2025-2026版)!新入选!
- 2025年中科院分区表已公布!Scientific Reports降至三区
- 国内核心期刊分级情况概览及说明!本篇适用人群:需要发南核、北核、CSCD、科核、AMI、SCD、RCCSE期刊的学者
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



