结冷胶裂解酶在毕赤酵母中的异源表达及其性质和应用
结冷胶是少动鞘氨醇单胞菌所产的多糖,其分子骨架由β(1→3)-D-葡萄糖、β(1→4)-D-葡萄糖醛酸、β(1→4)-D-葡萄糖和α(1→4)-L-鼠李糖线性四糖重复单元按摩尔比1∶1∶1∶1聚合组成,分子质量达0.5×106~1×106 Da[1-3]。结冷胶寡糖可由结冷胶降解得到,具有益生活性[4]、植物诱导抗病性[5]、提高免疫活性[6]等生物学功能,其制备具有重要意义。寡糖一般通过物理、化学、生物(酶)法降解多糖制备,比较3类方法,酶法特异性强,产物均一,是较理想的方法[7]。目前,缺乏有效降解结冷胶的酶是结冷胶及其寡糖应用的最大障碍。
结冷胶裂解酶(EC 4.2.2.25,gellan lyase)特异性裂解结冷胶主链的糖苷键,释放非还原端为不饱和葡萄糖醛酸的葡萄糖醛基-葡萄糖基-鼠李糖基-葡萄糖四糖单元[8]。MIYAKE等[9]对来自Bacillus sp.GL1的结冷胶裂解酶在大肠杆菌中胞内表达,并对其应用进行了研究。通过基因工程技术获得重组的功能蛋白,是进行工业用高效蛋白生产的重要途径[10]。除大肠杆菌,目前研究比较深入的重组蛋白表达系统还有枯草芽胞杆菌和毕赤酵母(Pichia pastoris)等[11]。较其他表达系统,毕赤酵母表达宿主遗传性能稳定、表达外源蛋白分泌效率高、产物便于分离纯化、诱导型菌株具有较完善的发酵策略,应用广泛[12]。在毕赤酵母表达系统中,醇氧化酶AOX1基因强启动子最为常用,受甲醇严格调节,诱导表达外源蛋白,能达到很高的生产水平[13]。
本研究首次应用毕赤酵母构建表达Bacillus sp.GL1来源结冷胶裂解酶基因,诱使结冷胶裂解酶胞外分泌,发酵扩大生产。经分离纯化,重组结冷胶裂解酶的酶学性质被测定,并利用其对结冷胶进行降解,这是对获得大量结冷胶裂解酶用于寡糖制备和工业应用的初步探索,为进一步开发利用结冷胶资源,扩大其应用范围提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
大肠杆菌JM109、毕赤酵母GS115及分泌型酵母表达载体pPIC9K均购自美国Invitrogen公司,并保藏于糖化学与生物技术教育部重点实验室。
1.1.2 试剂与仪器
限制性核酸内切酶(EcoR Ⅰ、Not Ⅰ和Sal Ⅰ)、DL-10 000 DNA Marker、SanPrep柱式质粒小量抽提试剂盒和Ezup柱式酵母基因组DNA抽提试剂盒等,大连TaKaRa公司;酵母粉、蛋白胨、甘油和无水甲醇等,国药集团化学试剂有限公司;结冷胶(食品级),无锡格莱克斯生物科技有限公司。
Micro Pulser型电转仪、C1000 Touch型PCR仪,美国Bio-Rad公司;3K15型高速冷冻离心机,德国Sigma公司;Bio Flo 115型7 L发酵罐,美国NBS公司;ultrafleXtreme型质谱仪,美国Bruker Daltonics公司。
1.1.3 培养基
LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,pH 7.0(固体培养基加入琼脂粉20 g/L)。
YPD培养基(g/L):蛋白胨20,酵母粉10,葡萄糖 20(固体培养基加入琼脂粉20 g/L)。
MD培养基(g/L):无氨基酵母氮源(yeast nitrogen base, YNB)13.4,生物素4×10-5,葡萄糖20,琼脂20。
MM培养基:YNB 13.4 g/L,生物素40 μg/L,甲醇5 mL/L,琼脂20 g/L。
BMGY培养基:酵母粉10 g/L,蛋白胨20 g/L,磷酸钾缓冲液100 mmol/L、pH 6.0,YNB 13.4 g/L,生物素40 μg/L,甘油10 g/L。
BMMY培养基:酵母粉10 g/L,蛋白胨20 g/L,磷酸钾缓冲液100 mmol/L、pH 6.0,YNB 13.4 g/L,生物素 40 μg/L,甲醇 10 mL/L。
上述培养基在121 ℃灭菌20 min或115 ℃灭菌30 min。
1.2 实验方法
1.2.1 重组表达质粒的构建及鉴定
选取Bacillus sp.GL1来源结冷胶裂解酶基因(GenBank ID:AB006853.1)中已报道的功能活性区域(N-terminal gellan lyase, nGL)[9],根据毕赤酵母(P.pastoris GS115)的偏好性进行密码子优化后委托生工生物工程(上海)股份有限公司合成结冷胶裂解酶基因(nGL1),获得商品重组克隆质粒pUC57-nGL1。根据优化后的基因序列设计引物,分别在引物5′和3′端分别加上EcoR Ⅰ和Not Ⅰ酶切位点及保护碱基。本研究中PCR扩增体系所用引物如表1所示。
表1 本研究所用引物
Table 1 Primers used in this study
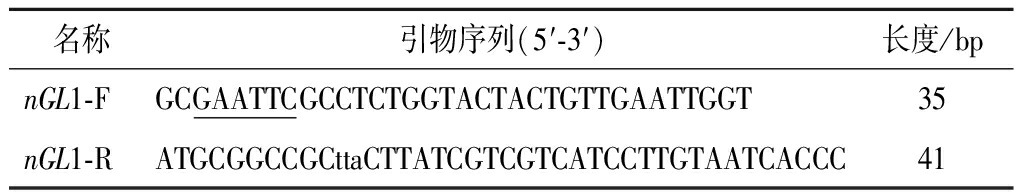
注:下划线部分为酶切位点,小写部分为保护碱基
pUC57-nGL1溶解稀释至一定浓度用EcoRⅠ、NotⅠ双酶切,经琼脂糖凝胶电泳鉴定、回收、纯化后,进而用T4 DNA连接酶连接到经过相同的工具酶线性化载体pPIC9K上,构建重组表达质粒pPIC9K-nGL1(图1),并转化到E.coli JM109感受态细胞中富集。选取含有氨苄抗性LB平板上阳性克隆子,提取质粒使用EcoR Ⅰ和Not Ⅰ进行单酶切和双酶切及菌落PCR鉴定。
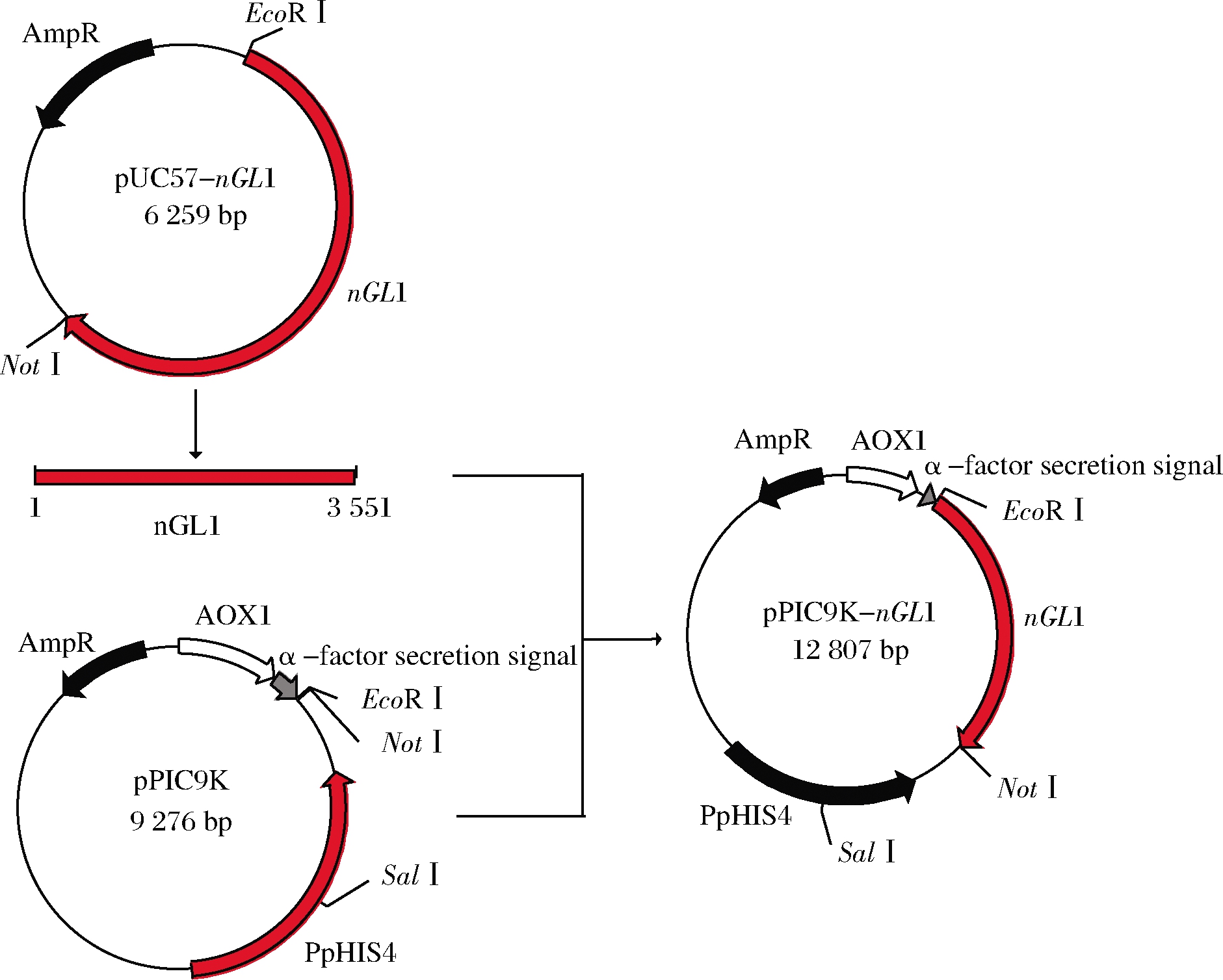
图1 重组表达质粒构建
Fig.1 Construction of recombinant expression plasmid
1.2.2 重组毕赤酵母的构建及验证
鉴定成功的pPIC9K-nGL1经SalⅠ酶切线性化后电转化入P.pastoris GS115染色体DNA中,30 ℃培养2~3 d,以得到转化子。采用MD/MM平板点植对照法筛选甲醇快速利用型(Mut+)表型,进一步通过YPD-遗传霉素(G418)平板筛选优良的表达菌株[14]。随机挑取其单菌落,接种于3 mL YPD液体培养基中,30 ℃、200 r/min过夜培养。以Ezup柱式酵母基因组DNA抽提试剂盒提取酵母基因组DNA为模板,进行PCR扩增,然后1.0%琼脂糖凝胶检测PCR结果。PCR鉴定正确的重组菌经测序验证目的基因整合到酵母基因组中,将测序正确的菌株命名为P.pastoris GS115-pPIC9K-nGL1并于-40 ℃甘油管中保藏。
1.2.3 重组结冷胶裂解酶活性的测定
取适量酶液与Tris-HCl缓冲液(50 mmol/L,pH 7.0)混匀,加入终质量浓度为0.5 g/L的底物结冷胶溶液激活反应,涡旋振荡1 min,于45 ℃水浴反应20 min后,煮沸10 min灭活。酶活力定义为在1 mL上述反应体系条件下,1 min转化底物生成1 μmol还原糖所需的酶量为一个单位U。二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定反应体系中还原糖浓度[15]。
1.2.4 重组结冷胶裂解酶的诱导表达与筛选
参考Invitrogen公司的毕赤酵母表达系统操作手册[16],挑取构建成功的重组毕赤酵母单菌落接种至50 mL BMGY培养基中,30 ℃、200 r/min培养至OD600=2.0~6.0,4 ℃、4 000×g离心5 min收集菌体。用100 mL BMMY培养基重悬并稀释至OD600=1.0,进行诱导培养;每隔24 h加入无水甲醇至终体积分数为0.5%,发酵120 h。发酵结束菌液4 ℃、8 000×g离心5 min收集上清液测定酶活力,并用8% SDS-PAGE检测蛋白质表达情况。
1.2.5 重组结冷胶裂解酶的分离纯化
发酵液上清液于80%饱和硫酸铵盐析沉降,沉淀物复溶后4 ℃透析过夜,而后经葡聚糖凝胶Sephadex-G100柱层析[17]。层析组分加到预先经Tris-HCl缓冲液(0.1 mol/L, pH 7.0)平衡的DEAE-52纤维素层析柱,用0~0.8 mol/L NaCl溶液(同种缓冲液配制)进行线性梯度洗脱,设置280 nm测紫外吸光值,分管收集[18]得到纯酶液,待处理样品进行SDS-PAGE分析。
1.2.6 重组结冷胶裂解酶的酶学性质研究
最适反应温度测定。分别在20、25、30、35、40、45、50、55、60、65、70 ℃条件下检测结冷胶裂解酶酶活性,设最高酶活力为100%,计算各水平条件下相对酶活力。
温度稳定性检测。取等量纯酶液置于45、50、55 ℃水浴锅中温育,每隔30 min取样,于冰上冷却5 min,保持其他反应条件不变,计算相对酶活力。
最适反应pH测定。保持其他反应条件不变,反应体系中加入相同体积的pH值为4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、9.0、9.5的Tris-HCl缓冲液,设最高酶活力为100%,计算相对酶活力。
pH稳定性检测。取等量纯酶液用相同体积的pH值为4、5、6、7、8、9、10、11的缓冲溶液悬浮,于4 ℃放置12 h,保持其他反应条件不变,随后计算相对酶活力。
金属离子稳定性检测。在酶反应体系中分别加入0.1 mol/L K+、Na+、Ca2+、Mg2+、Al3+、Zn2+、Fe3+、Mn2+,以不加金属离子Tris-HCl缓冲液的酶的活性为100%,计算相对酶活力。
1.2.7 重组毕赤酵母工程菌的7 L发酵罐高密度培养
接种重组毕赤酵母单菌落于BMGY培养基,30 ℃、200 r/min培养24 h即得种子液。将2.7 L BMGY培养基加入7 L发酵罐内,经灭菌处理后调节发酵体系维持在30 ℃、pH 6.0并稳定2 h。随后加入300 mL种子液。对发酵罐的通气量和转速进行调节,维持溶氧在20%上下,培养20~24 h,使得发酵液中的所有甘油被消耗完。此时进入展开甲醇诱导培养阶段,调pH 6.0,并处于30 ℃条件下。利用同时反馈控制办法进行在线测定[19],甲醇质量浓度维持在10 g/L。发酵过程中,每间隔6 h需要对典型生化指标进行测定和记录,如生物量和结冷胶裂解酶活力。
1.2.8 重组结冷胶裂解酶的裂解产物分析
以低质量浓度0.5 g/L的结冷胶溶液为底物进行酶促降解反应,每隔30 min取样,用展开剂(正丙醇∶乙酸∶水=5∶2∶3,体积比)于Merck薄层板(TLC Silica gel 60F 254, 20×20 cm)上将产物分离进行薄层色谱法(thin-layer chromatography,TLC)分析。为进一步鉴定降解产物,反应结束后样品经0.22 μm水系膜过滤器过滤后以2,5-二羟基苯甲酸(2,5-dihydroxybenzoic acid,DHB)为基质,利用基质辅助激光解析电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry, MALDI-TOF-MS)在正离子模式下对产物寡糖的质荷比进行分析,以确定结冷胶寡糖的聚合度[20]。
1.3 数据处理
实验设置3次平行,测定参数取平均值,利用Origin 8.5软件绘制图表并进行数据处理分析。
2 结果与分析
2.1 重组毕赤酵母的构建及筛选
阳性克隆子经菌落PCR验证提取重组质粒并分别使用EcoR Ⅰ和Not Ⅰ进行单酶切和双酶切验证。结果如图2-a,在琼脂糖凝胶上EcoR Ⅰ或Not Ⅰ单酶切的产物大小约12 827 bp的单条带,EcoRⅠ和NotⅠ双酶切分别得到3 551 bp的nGL1片段和9 276 bp的线性pPIC9K片段,表明重组表达质粒pPIC9K-nGL1构建成功。
经电转、筛选,随机选择8株阳性转化子于YPD液体培养基中扩培,然后取适量菌液PCR验证,结果如图2-b,在琼脂糖凝胶3 551 bp的位置上有明显条带即nGL1片段,表明重组质粒pPIC9K-nGL1已成功电转化入毕赤酵母GS115细胞中,经进一步测序表示基因工程菌重组P.pastoris GS115-pPIC9K-nGL1构建成功。
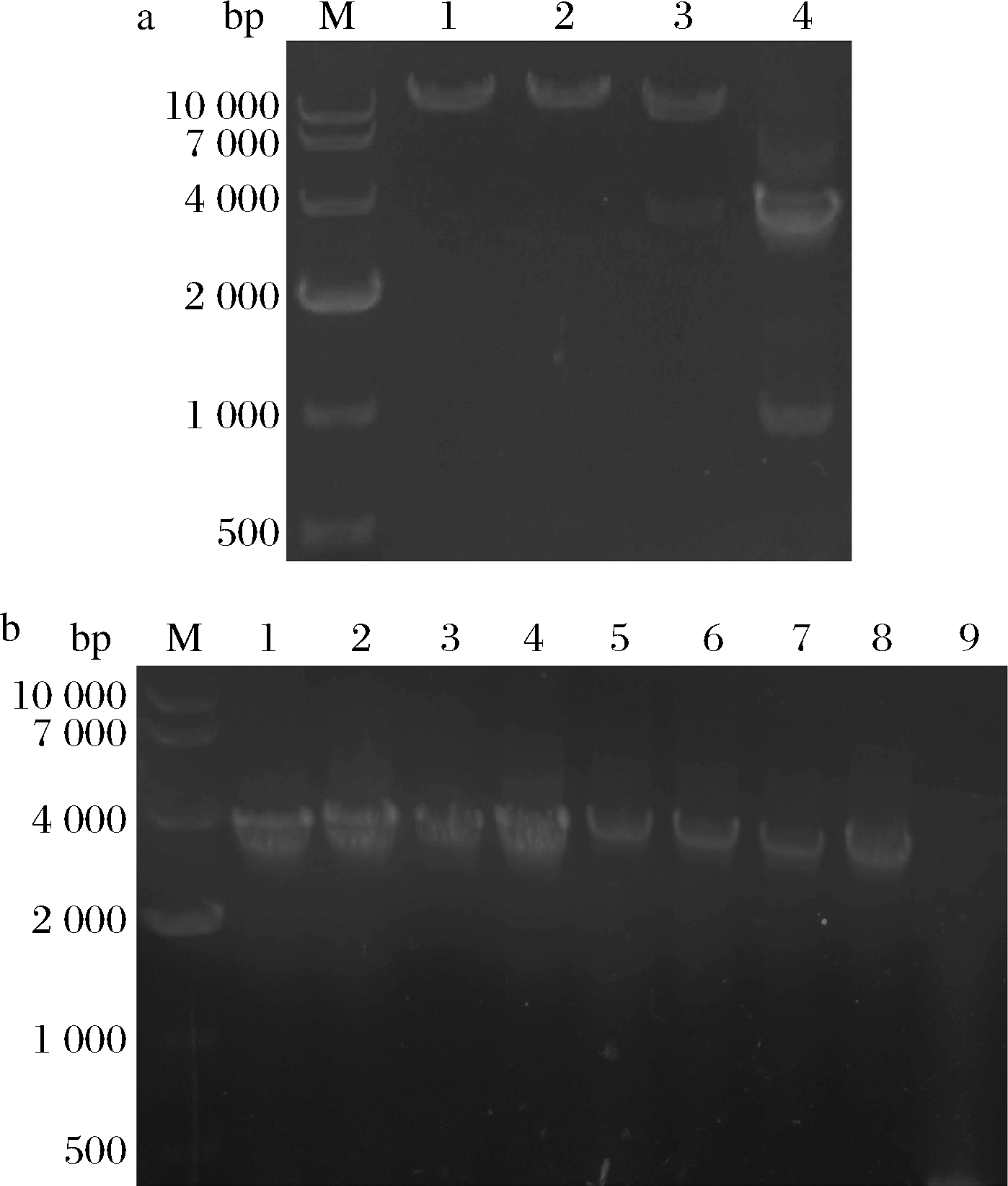
a-重组表达质粒电泳鉴定图(M-Marker;1-NotⅠ单切; 2-EcoRⅠ单切;3-NotⅠ和EcoRⅠ双切;4-菌落PCR); b-重组毕赤酵母电泳验证图(M-Marker; 1~8-阳性转化子PCR结果;9-空质菌PCR结果)
图2 重组毕赤酵母的构建及验证筛选
Fig.2 Construction and validation of recombinant P.pastoris
2.2 重组结冷胶裂解酶的诱导表达及鉴定
利用ExPASy预测本研究中结冷胶裂解酶分子质量约为125 kDa。重组毕赤酵母摇瓶诱导表达并测定酶活力,如图3-a,筛选得到高酶活力菌株P.pastoris GS115-pPIC9K-nGL1.2酶活力为266.4 U/L。
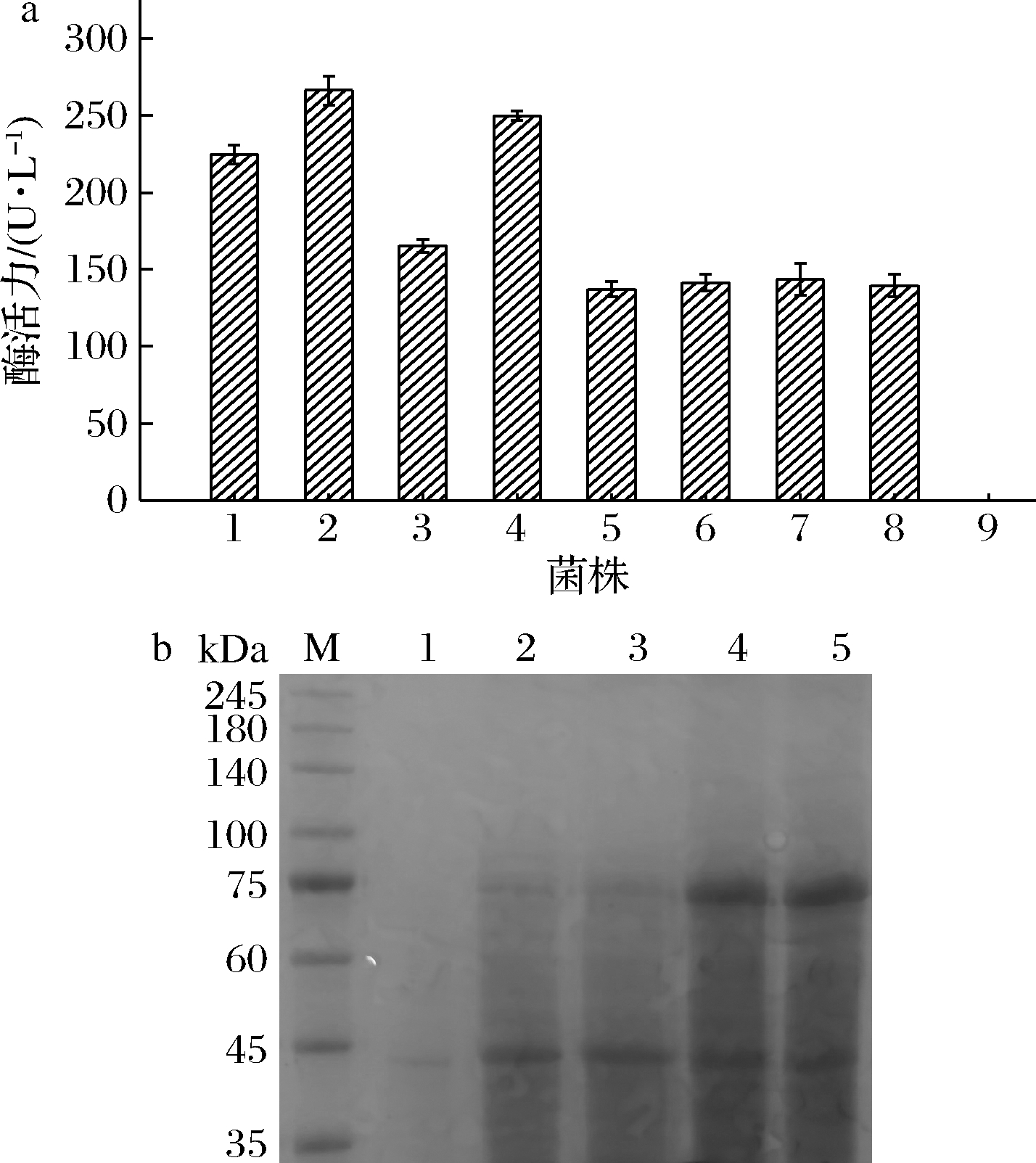
a-重组结冷胶裂解酶高酶活菌株筛选 (1~8-阳性转化子;9-空质菌); b-重组结冷胶裂解酶SDS-PAGE电泳分析(1-空质菌上清液; 2、3-重组菌上清;4、5-初步纯化后酶液)
图3 重组结冷胶裂解酶的诱导表达及鉴定
Fig.3 Induced expression and identification of recombinant gellan lyase
用相同方法培养处理空质菌P.pastoris GS115-pPIC9K作为空白对照。分别取适量粗酶液处理进行SDS-PAGE分析,结果如图3-b,P.pastoris GS115-pPIC9K-nGL1.2上清液与空质菌对照相比在分子质量75和45 kDa处均有明显的蛋白表达带。进一步分离纯化重组结冷胶裂解酶,经过SDS-PAGE电泳检测,所得纯化酶液位置与粗酶液加粗条带一致,大小正确。但所收集组分未分离开,表现为电泳条带无单条存在,分析可能是结冷胶裂解酶发生降解。
2.3 重组毕赤酵母工程菌的7 L发酵罐高密度培养
对高酶活力菌株P.pastoris GS115-pPIC9K-nGL1.2进行7 L发酵罐高密度培养,结果如图4所示,随着发酵的进行,重组毕赤酵母生物量最高达78.5 g/L,结冷胶裂解酶酶活力达954.6 U/L,相比于摇瓶表达最高酶活力(266.4 U/L)提高了3.58倍。
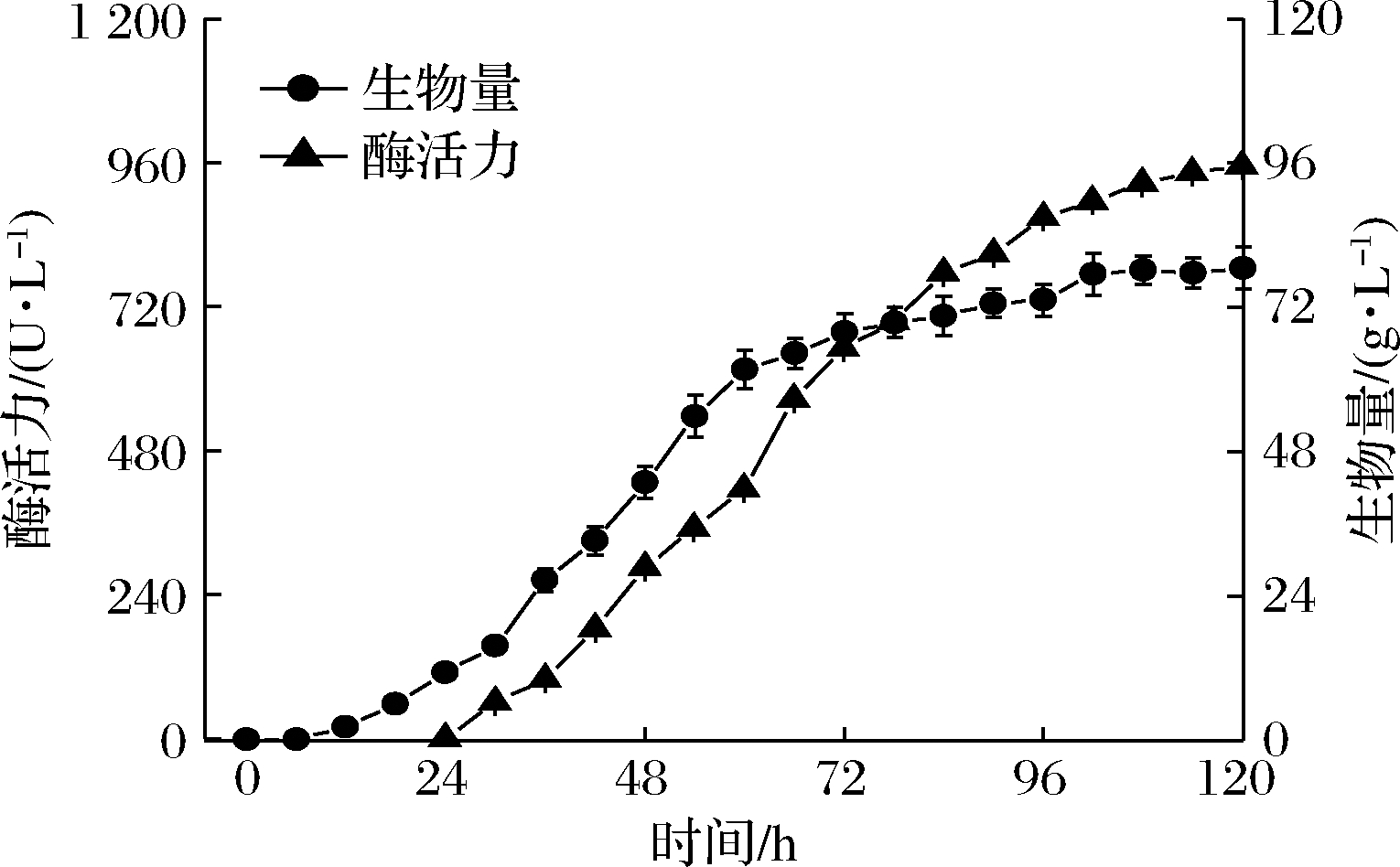
图4 重组毕赤酵母7 L发酵罐发酵
Fig.4 Recombinant P.pastoris fermentation in 7 L bioreactor
2.4 结冷胶裂解酶的酶学性质研究
2.4.1 重组结冷胶裂解酶反应的最适温度及温度稳定性
温度影响酶的空间结构。在一定温度范围内,温度升高,酶反应速率提高;高温或低温都会降低酶的催化效率,温度过高甚至引起不可逆的蛋白变性[21]。研究结果见图5-a,在30~50 ℃时,重组结冷胶裂解酶相对酶活力超过80%。其中,相对酶活力在45 ℃时最高,这与原始菌裂解酶性质一致[9]。该重组酶温度稳定性结果如图5-b,总体而言,酶活力的降低同保温时间呈正相关关系;45 ℃下酶活力降低速度相对较缓,即使放置10 h相对酶活力依然大于80%。重组酶对反应温度和保藏温度要求较高,选择合适的条件是提高寡糖产量的基础。
2.4.2 重组结冷胶裂解酶反应的最适pH及pH稳定性
pH的改变影响酶分子中具有催化活性的离子基团解离程度,从而影响酶的催化能力[22]。由图5-c可知结冷胶裂解酶最适pH 7.5,当pH值低于7.5时,酶活力迅速下降,当pH值降低到5.0时相对酶活力几近为0。重组酶在弱碱性条件下容易发挥较大活性,考察重组结冷胶裂解酶的pH稳定性,反应结果如图5-d所示。从图中明显看出结冷胶裂解酶具有较大的耐碱范围,这与其最适反应pH结果一致。当pH值处于7.0~9.0时,呈现出较为稳定的状态,剩余酶活力高于80%,相比于原始菌稳定性得到了一定提升[9]。可能原因是毕赤酵母的糖基化功能,提高了重组酶的温度稳定性[10]。结果表明弱碱环境适合结冷胶裂解酶降解结冷胶。
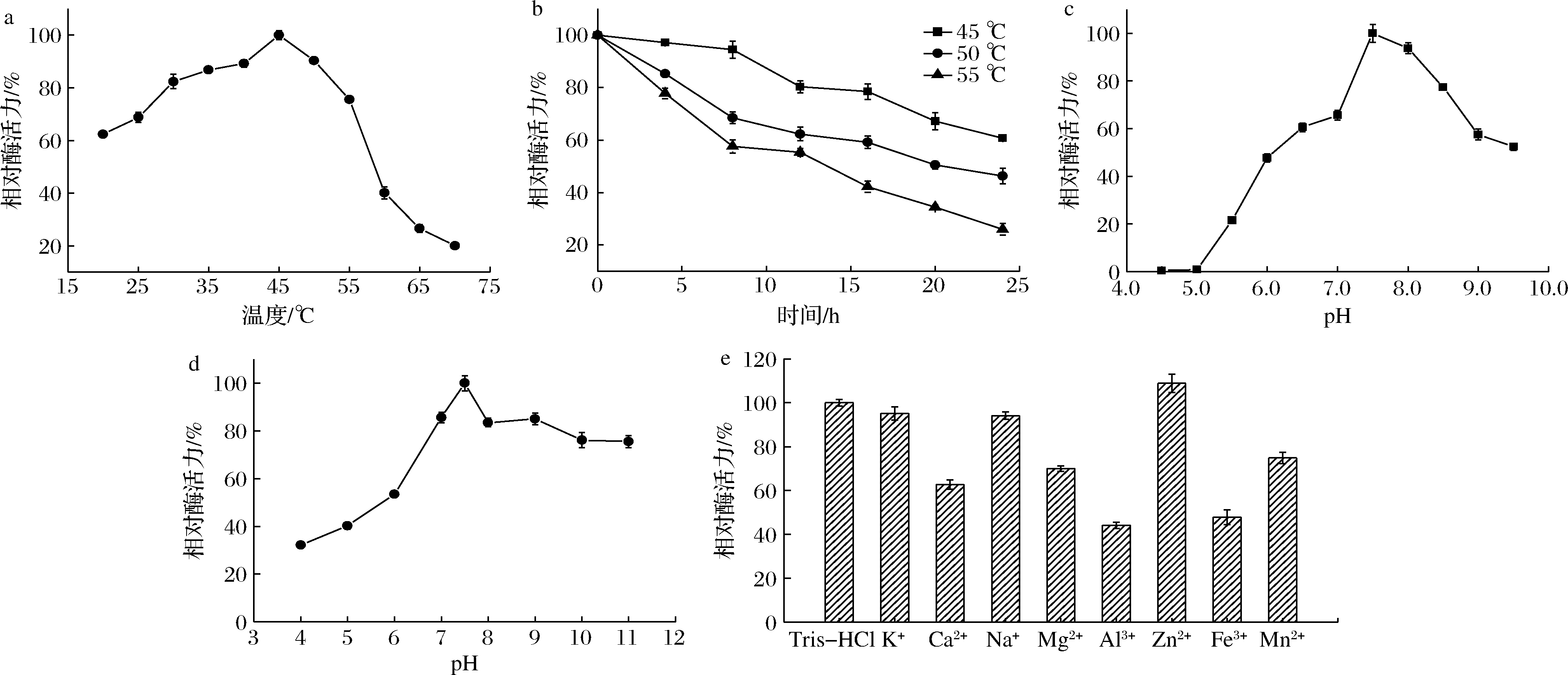
a-最适温度;b-温度稳定性;c-最适pH;d-pH稳定性;e-金属离子稳定性
图5 重组结冷胶裂解酶酶学性质
Fig.5 Enzymatic properties of recombinant gellan lyase
2.4.3 重组结冷胶裂解酶反应的金属离子稳定性
金属离子通过与氨基酸残基结合,影响酶活力[22]。以不含金属离子的Tris-HCl缓冲液反应体系作为对照,考察不同金属离子(K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Fe3+、Mn2+)对重组结冷胶裂解酶酶促反应的影响。结果如图5-e,K+、Na+对重组酶酶活力既没有促进作用,也没有明显的抑制作用,影响并不大;Zn2+对重组酶有微弱的促进作用,酶活力为对照组的108.9%;Ca2+、Mg2+、Al3+、Fe3+和Mn2+对重组酶则有着不同程度的抑制作用,其中Al3+抑制作用最强,相对酶活力仅44%。
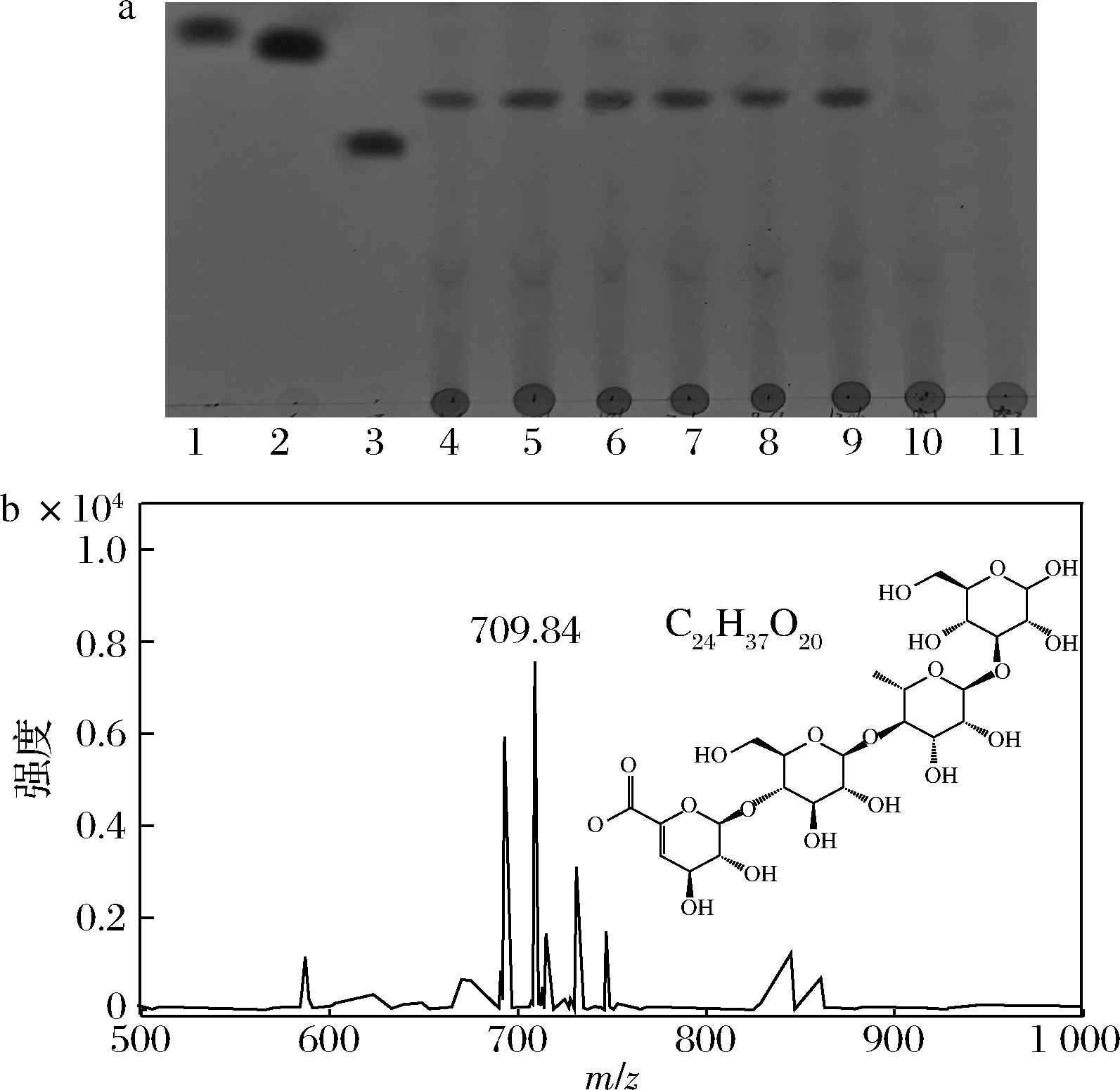
a-结冷胶寡糖TLC分析图(1-葡萄糖标品;2-蔗糖标品; 3-β-环糊精标品;4~10-30、60、90、120、150、180、0 min 结冷胶寡糖样品;11-阴性对照组);b-结冷胶寡糖 MALDI-TOF-MS分析图
图6 结冷胶裂解酶降解产物分析
Fig.6 Degree of polymerization of gellan oligosaccharide
2.5 结冷胶裂解酶降解产物分析
应用TLC联用MALDI-TOF-MS分析结冷胶裂解酶降解产物。从图6-a中可以看出,结冷胶裂解酶降解结冷胶的产物主要为一种,且随着时间的延长,产物的种类没有明显的增加。如图6-b,从降解产物的MALDI-TOF-MS分析结果来看,样品被有效地离子化,得到阳离子化准分子离子(quasi-molecular ion)峰 [M+Na]+m/z=709.84,与结冷胶的明显特征单元残基吻合,判断结冷胶的降解产物聚合度大致为4。说明重组结冷胶裂解酶可以有效降解结冷胶,具有特异性。根据结冷胶分子结构可初步确定该结冷胶寡糖是非还原端为不饱和葡萄糖醛酸的葡萄糖醛基-葡萄糖基-鼠李糖基-葡萄糖四糖单元,这与文献报道相符[8]。因此,利用毕赤酵母异源表达的结冷胶裂解酶可以有效制备聚合度为4的结冷胶寡糖。
3 结论
首次成功将经优化的Bacillus sp.GL1来源的结冷胶裂解酶基因在毕赤酵母中进行了表达,构建了重组菌P.pastoris GS115-pPIC9K-nGL1。将重组菌在摇瓶水平诱导表达,获得最高酶活力为266.4 U/L。进一步在7 L发酵罐中进行高密度培养,酶活力达954.6 U/L,较摇瓶水平提高了3.58倍。通过分离纯化得到结冷胶裂解酶纯酶并对其酶学性质展开研究,分析结果表明结冷胶裂解酶的最适反应温度为45 ℃,当温度大于45 ℃时酶活力开始迅速下降,在50 ℃以上稳定性较差;结冷胶裂解酶在pH 6.0~7.5内酶活力都维持较高的水平,最适反应pH 7.5,在酸性环境中稳定性比较差;Zn2+对酶活力有促进作用,Al3+显著抑制酶活力。另外,以0.5 g/L结冷胶为底物,通过酶促降解反应生成聚合度为4的结冷胶寡糖,为其工业制备提供了一种可行性方案。
- GB/T 7714-2025与GB/T 7714-2015相比,变更了哪些,对期刊参考文献格式有什么影响?
- 别被这个老掉牙的报纸理论版投稿邮箱误导了!最新核实91个报纸理论版投稿邮箱通道,一次集齐
- 喜报!《中国博物馆》入选CSSCI扩展版来源期刊(最新CSSCI南大核心期刊目录2025-2026版)!新入选!
- 2025年中科院分区表已公布!Scientific Reports降至三区
- 国内核心期刊分级情况概览及说明!本篇适用人群:需要发南核、北核、CSCD、科核、AMI、SCD、RCCSE期刊的学者
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



