光热驱动多孔氧化铈热化学循环解水制氢非热质平衡模型
在高比例可再生能源电力系统框架及“双碳”目标驱动下,将太阳能直接转化为化学燃料(如氢气或合成气)并进一步转化为液体可再生燃料,为太阳能的长期储存、运输及利用提供了合理途径[1-5]。通过分解H2O和(或)CO2将太阳能直接转化为燃料有多种方法,其中大多数是低温光子驱动(光催化),只利用太阳谱的部分能量[6]。采用聚光光热来驱动热化学循环反应,通过载氧体的氧化还原实现氧的循环输运,提供了一个具有热力学吸引力的可持续的太阳燃料生产途径,同时易于碳捕集[7-9]。热化学循环反应又称两步反应,首先是载氧体的热还原,晶格氧在内外氧梯度的作用下,自体相向表面不断释放氧气;其次是在氧化步中,氧空位被CO2或H2O再次氧化,同时产生燃料。
在各种可能的候选材料中,氧化铈(CeO2)因其较高的稳定性及再氧化动力学特性,首先被应用于太阳能反应堆中[10]。Furler等[11-12]制备了纤维毡、网状多孔陶瓷(RPC)以及双尺度RPC等不同形态载氧体,结果显示在近1600℃的还原温度下,多孔结构比致密结构的非化学计量数提高了近4倍,双尺度RPC提供了更快的燃料产率。近两年生态陶瓷如纤维板、泡沫和仿生软木等仿生泡沫陶瓷结构也被应用于太阳能反应器的开发[13]。Venstrom等[14-15]合成了具有高比表面积且具有连通性的3-DOM孔隙结构材料,显著改善了其再氧化动力学性能,相比于RPC氧化铈材料,其燃料的峰值产率提高了2.6倍,可见载氧材料宏、细观结构的不同,显著影响多孔载氧体与反应性气体的热、质的交换过程。
为进一步优化上述过程并获得可靠的性能预测,载氧体的氧化还原动力学信息至关重要。Panlener等[16]系统阐述了氧化铈的非化学计量并对热力学特性进行了定量描述,这一数据被修正并作为氧化铈反应动力学的经典参数一直沿用至今。Mogensen等[17]提取了氧化铈和掺杂二氧化铈在200~1000℃温度范围内的物理、化学、电化学的可用数据,评价了氧化铈在固体氧化物燃料电池等应用中的潜力和局限性。Chueh等[18]提出了适用于氧化铈的统一热力学和动力学分析模型,结果表明在无热回收条件下,太阳能到燃料的转换效率可以达到16%~19%。此外,近年来以氧化铈为载氧体针对甲烷湿重整、二氧化碳和水裂解等过程进行燃料制备的研究,对氧化铈表面的吸附、解离、脱附等物理化学机理进行研究[19-21],并给出了动力及热力学理论模型。Bulfin等[22]给出了基于阿氏方程的氧化铈热还原过程动力学方程,为反应器的放大与优化设计提供了更为便捷的工具。
在反应器系统的集成和设计方面,Sheu等[23]对太阳能热化学燃料制备所涉及的循环形式及膜过程进行了总结;Lyu等[24]详细讨论了针对氧化铈材料的反应原理、材料改性、反应动力学以及最终开发和运行的太阳能反应器,提供了对影响系统效率的因素的全面理解;Steinfeld等[25]开展了大量针对氧化铈吸热器的设计与优化工作,设计制造了双腔体的反应器原型机,并开展相应的仿真与模拟,但其只针对热还原过程采用热力学模型进行了模拟,并未考虑再氧化过程中的H2O及CO2反应动力学过程;Patil等[26]、Zoller等[27]分别对反应器的辐射-对流传热进行了建模与实验分析,其反应器在1000℃的热效率超过75%,从而证明了高温反应器热管理方面的巨大潜力。
目前针对氧化铈热化学循环的研究较多集中于材料理化特性及反应动力学,在热质传递方面的研究多集中于热还原过程建模仿真,对燃料生产的再氧化过程(以H2O和(或)CO2为氧化剂)热质传递的相关研究较少,尤其缺乏考虑孔隙尺度界面机理的统一模型。为此,本文以热化学循环解水过程为研究对象,提出一种针对多孔载氧体的非热质平衡模型,该模型以光热驱动条件下的辐射传递为热边界,同时将颗粒内部的氧输运过程、表界面的解水过程与宏观尺度的热质输运相耦合,可为类似物理化学过程的建模、仿真与优化分析提供一套完整的理论参考。
1 模型
本文仅考虑一维过程(图1),即将上述反应器简化为一个单侧(与反应物入口同侧)受照的多孔氧化铈固定床,入口氧化及还原性气体分别为H2O和H2[28]。在轴向(流动方向)上,考虑入射辐射的散射、吸收及其与固相的耦合,即宏观尺度考虑多孔介质耦合传热,在微观尺度上考虑载氧体颗粒(或晶粒)径向的氧空位扩散过程,通过界面方程将两个尺度的热质传递过程耦合。
图1
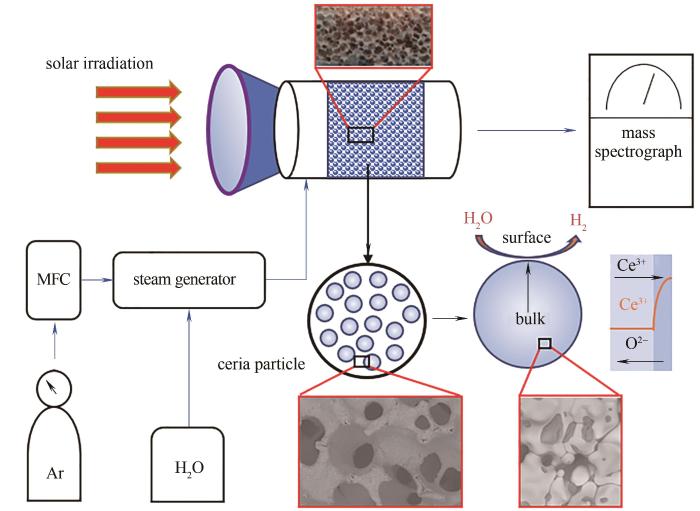
图1 反应器示意图
Fig.1 Schematic diagram of reactor
连续与动量方程
式中, u 是流体的速度矢量;K为渗透率;F为流动阻力系数。K和F可分别通过Ergun方程给出。
非热平衡模型
为更精确地描述颗粒尺度的径向传质过程,在经典LTNE模型基础上补充了一个径向传热方程,即考虑更精确地描述各种尺度的孔/颗粒的传热过程。
气相能量方程:
固相能量方程(表观):
固相能量方程(细观):
界面反应动力学模型
氧化铈解水是一个可逆的氧化还原过程,还原和再氧化过程分别以H2和H2O为还原剂和氧化剂,其表面缺陷化学方程如
其中,
在电子转移过程中,羟基离子的O—H再次断裂,两质子结合形成H2分子并脱附,氧离子与三价铈离子结合成四价铈离子,生成晶格氧。
利用质量守恒定律,表面反应式(9)和
其中,
体相氧空位
模型部分变量参数参考值见表1。
表1 模型部分变量参数参考值
Table 1
| 参数 | 数值 |
|---|---|
| 多孔床(氧化铈) | |
| 床层孔隙率φ/孔径dp | 0.8/2 mm |
| 氧化铈密度 | |
| 晶格常数a* | 0.54112 nm |
| 晶格氧扩散系数 | |
| 表面摩尔密度 | |
| 体积摩尔密度 | |
| 颗粒表面积 | 3.14 |
| 比表面积αsf[29] | |
| 反应床厚度L | 21.6 mm/50 mm |
| 多孔体积密度 | |
| 动力学参数[29] | |
| 反应式(9)正反应活化能 | -7 kJ/mol |
| 反应式(9)逆反应活化能 | -230 kJ/mol |
| 反应式(10)正反应活化能 | -190 kJ/mol |
| 反应式(10)逆反应活化能 | -102 kJ/mol |
| 反应式(9)正反应动力学参数 | 130 |
| 反应式(9)逆反应动力学参数 | |
| 反应式(10)正反应动力学参数 | |
| 反应式(10)逆反应动力学参数 | |
| CeO2体积缺陷平衡反应摩尔焓 | -113.7 J/mol |
| CeO2体积缺陷平衡反应摩尔熵 | -42.1 J/(mol·K) |
| 实验参数 | |
| 还原气浓度 | |
| 氧化气浓度 | |
| 进气压力 | |
| 进气流量 | 0.2 g/s |
| 进气黏度 | |
| 进气密度 | |
| 进气温度 | 100℃ |
| 床层温度 | 恒温1000℃/ 辐射热通量1 MW/m2 |
| H2初始摩尔分数 | 0.1/0.143/0.2/0.3/0.4/0.5/0.6 |
| H2O初始摩尔分数 | 0.1/0.2/0.26/0.3/0.4 |
新窗口打开| 下载CSV
非质平衡模型
气相组分输运方程(表观):
固相组分输运方程(细观):
式中,
式中,
辐射输运模型辐射输运相对流动和反应是瞬态的,即多孔介质内部的辐射过程只受孔隙结构及介质温度的影响,对于多孔吸热器内部的辐射输运采用修正的微分近似P-1模型[31],即关于散射入射辐射
沿垂直于边界的路径经过吸收和散射部分消光后的残余准直辐射通量的精确解(
2 模型验证
将模型还原和再氧化过程与Zhao等[29]实验测得的数据对比,分别对比产物H2O和H2在氧化铈床层出口处浓度变化。由结果(图2)可见,在还原阶段,H2迅速与表面晶格氧
图2
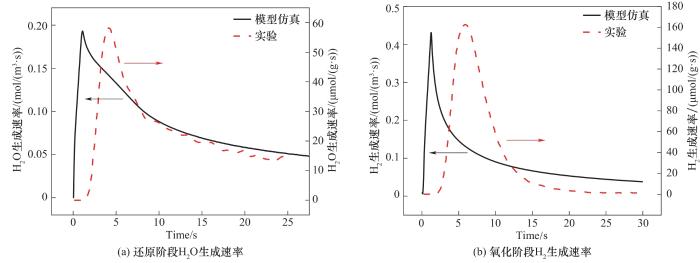
图2 氧化铈颗粒还原和氧化阶段生成物产生速率与参考实验[29]对比
Fig.2 Comparison of product generation rates of ceria particles in reduction and oxidation stages with reference experiments[29]
3 结果与分析
3.1 光热驱动条件下的非稳态过程
光热驱动条件下,床层入口投入辐射热通量qin=1 MW/m2,图3给出了还原阶段氧化铈反应床轴向(x轴)和当地颗粒径向(y轴)两个维度上的温度Ts以及氧空位浓度
图3
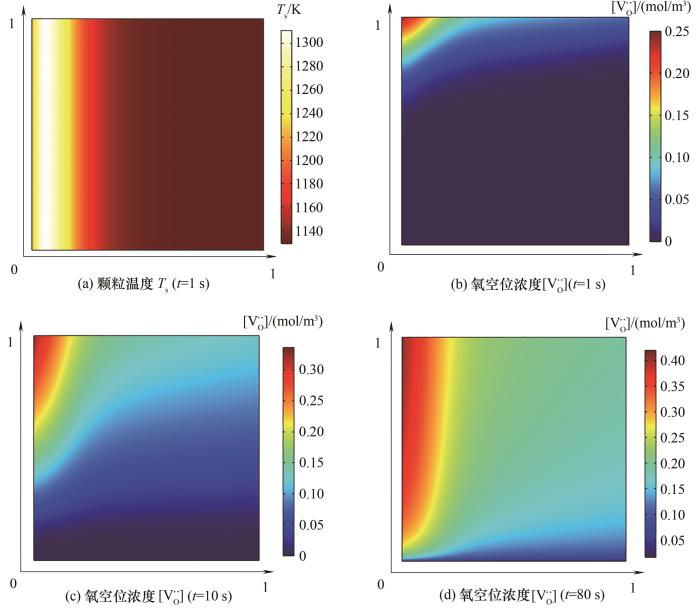
图3 还原步床层温度Ts及氧空位浓度
Fig.3 Temperature Ts and oxygen vacancy concentration
图4给出氧化阶段
图4
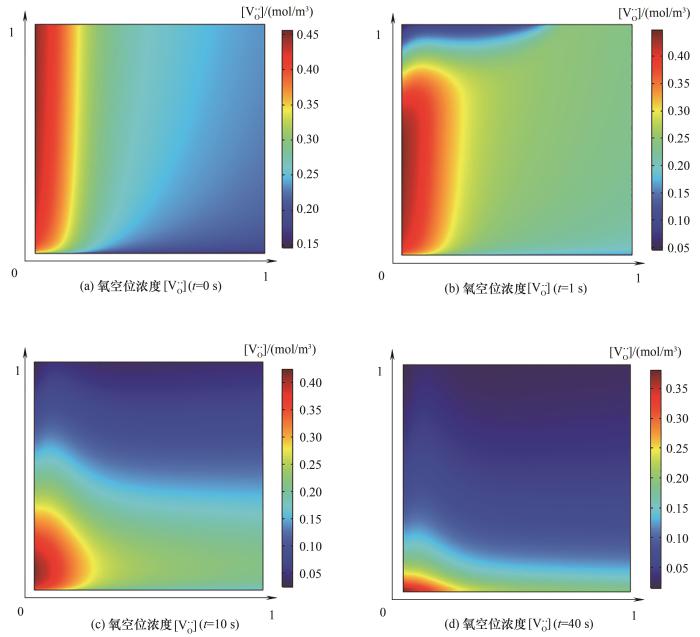
图4 氧化步床层氧空位浓度
Fig.4 Unsteady change of bed oxygen vacancy concentration
3.2 辐射热通量影响
入射辐射在多孔介质中的分布具有强烈的衰减特性及温度梯度,图5给出入射辐射热通量qin对床层内气固两相温度的影响。由图可见,辐射的体积效应明显,固相温度先升后降,气相温度迅速升高,在出口处实现气固两相的热平衡。床层最高温度随着入射辐射热通量的增大而增大。对应的qin=0.8 MW/m2时固相温度最高值仅为709.04℃,而入射辐射热通量qin=1.2 MW/m2时固相温度最高值可以达到1143.93℃。
图5
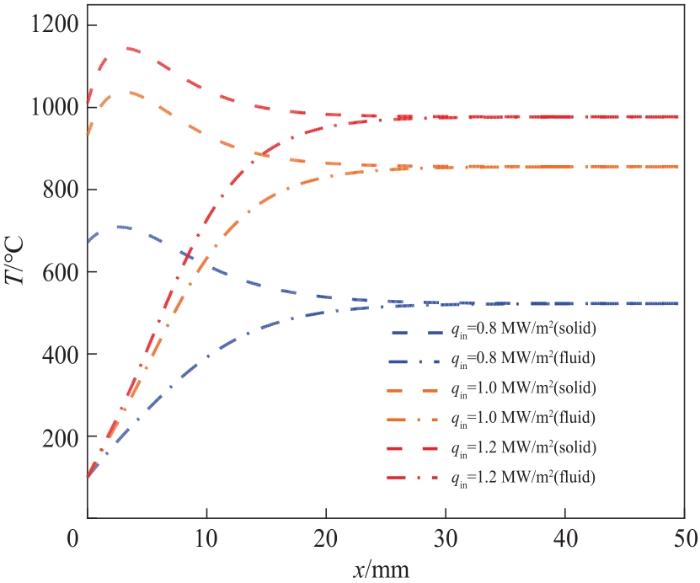
图5 氧化铈床层两相温度变化
Fig. 5 Two-phase temperature change of cerium oxide bed
进一步,床层温度的分布直接影响反应动力学,图6给出了不同qin对
图6
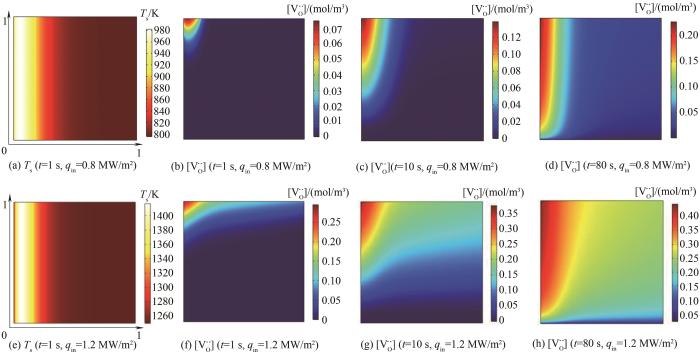
图6 还原步不同qin床层温度Ts及氧空位浓度
Fig.6 Bed temperature Ts and oxygen vacancy concentration
图7
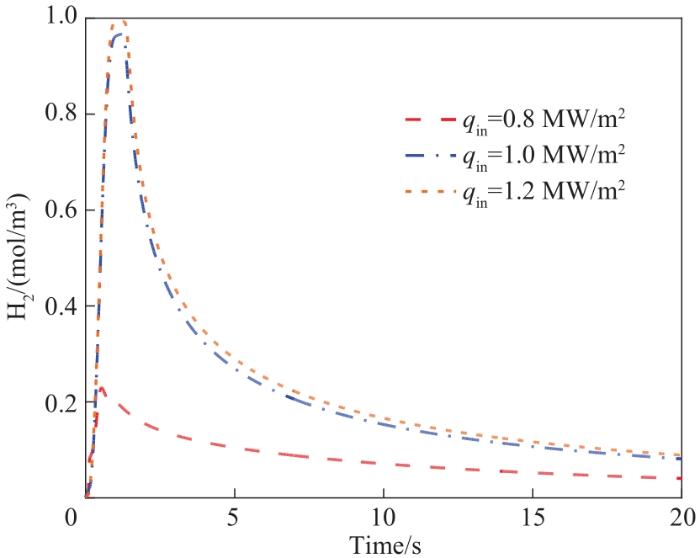
图7 不同qin氧化阶段床层出口H2浓度变化
Fig.7 Variation of H2 concentration at bed outlet of different qin in the oxidation step
3.3 反应物浓度的影响分析
图8给出了还原剂(H2/Ar混合气)H2浓度对床层出口H2/H2O混合物中的浓度
图8
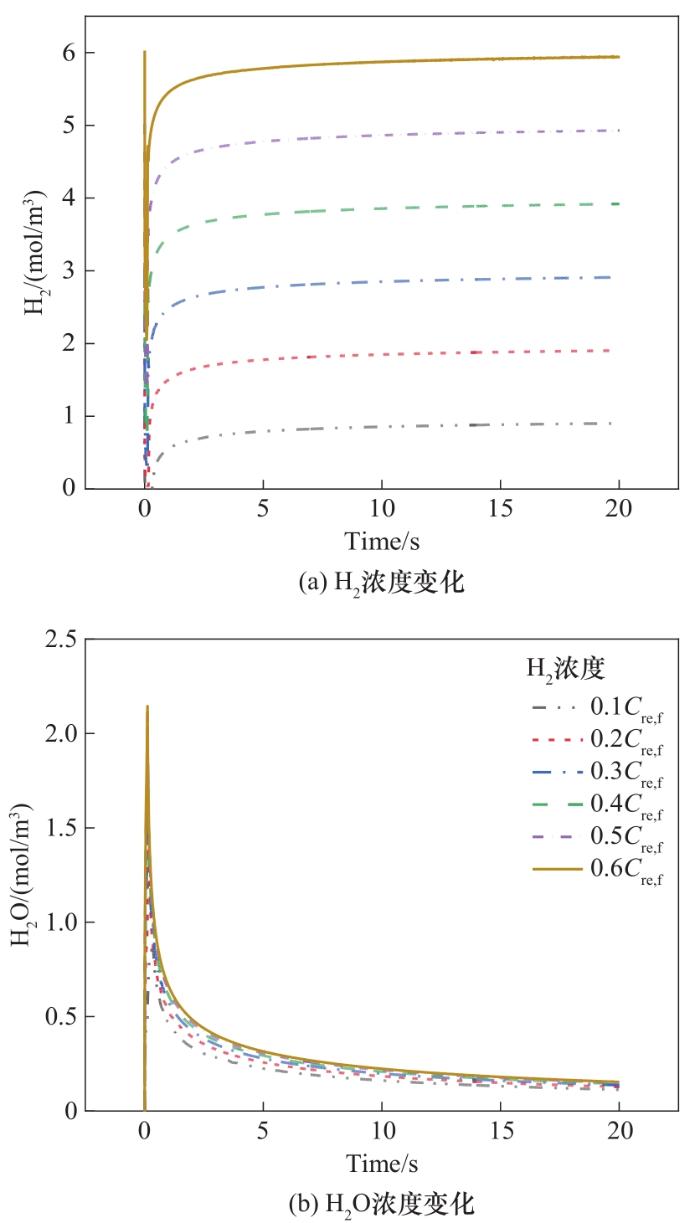
图8 还原阶段床层出口气体浓度变化
Fig.8 Variation of molar concentration of gas at outlet of bed in the reduction stage
以不同浓度的H2O作氧化剂,以0.6
图9
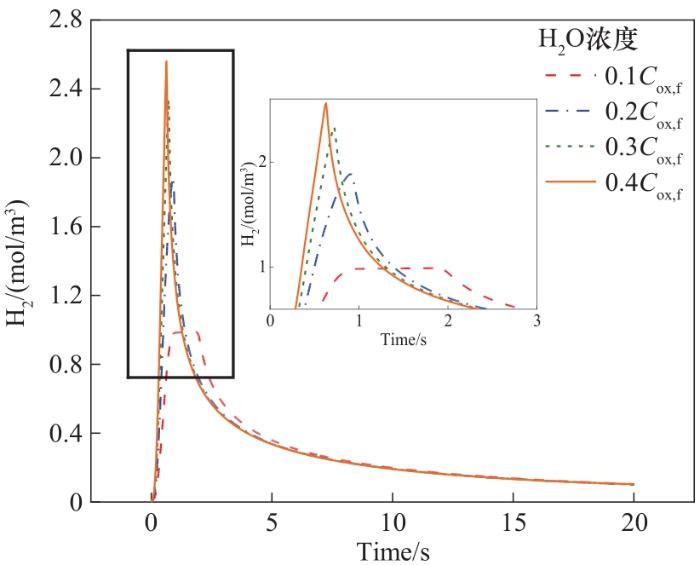
图9 氧化阶段床层出口H2浓度变化
Fig.9 Variation of H2 concentration at bed outlet in the oxidation step
4 结论
本文提出了一种光热驱动条件下以辐射传递为热边界,同时将颗粒内部的氧输运过程、表界面的热化学循环解水过程与宏观尺度的热质输运耦合起来的统一数学模型;与现有的实验数据对比,验证了模型的有效性。基于此模型,在光热驱动动态过程上探讨了改变入射辐射热通量及反应物浓度等参数对本模型的影响。主要结论总结如下。
(1)非热平衡效应对床层轴向温度及反应动力学有着显著影响;在反应床多孔结构体积效应的作用下,最大氧空位浓度出现在床层上游。动态分析表明,还原和氧化过程分别在80 s和40 s内基本完成,载氧体床层的轴向和径向氧空位输运过程的时间尺度处于同一数量级。
(2)入射辐射热通量越大,床层表面温度越高、反应速率越快,且对反应初期的反应速率影响更明显;在热通量较小情况下,轴向氧空位梯度在温度梯度的作用下略大于径向分布。
(3)反应物浓度的提升可以有效提高产物峰值;氧化阶段H2生成不仅受限于氧化剂浓度,要综合考虑还原剂组分浓度流量与反应动力学的耦合,以及考虑床层多孔结构的辐射对流传热耦合及其温度均匀化。
符号说明
| 浓度,mol/m3 | |
| 比定压热容,J/(kg·K) | |
| 扩散系数,m2/s | |
| 颗粒粒径,μm | |
| 惯性系数 | |
| 入射辐射梯度 | |
| 流固传热系数 ,W/(m3·K) | |
| 表面传质通量,mol/(m2·s) | |
| 体相扩散通量,mol/m2 | |
| 渗透率,m2 | |
| 逆反应的速率系数,s-1 | |
| 正反应的速率系数,s-1 | |
| 颗粒表面的交换系数,m/s | |
| 垂直颗粒表面向外的单位矢量 | |
| 压力,Pa | |
| 热通量,W/m2 | |
| 颗粒表面热通量,W/m2 | |
| 初始热通量,W/m2 | |
| 通用气体常数,J/(mol·K) | |
| 颗粒表面的反应速率,mol/(m2·s) | |
| 反应速率,s-1 | |
| 流体方向上的单位矢量 | |
| 温度,K | |
| 速度矢量,m/s | |
| 颗粒比表面积 | |
| 消光系数 | |
| 吸收系数 | |
| 动力黏度,kg/(m2·s) | |
| 化学势 | |
| 密度,kg/m3 | |
| 表面摩尔密度,mol/m2 | |
| Stefan-Boltzmann常数 | |
| 散射系数 | |
| 孔隙率 | |
| 下角标 | |
| c | 平行 |
| d | 扩散 |
| eff | 有效 |
| f | 流体相 |
| 指定组分 | |
| p | 产物 |
| s | 固体相/颗粒表面 |
- GB/T 7714-2025与GB/T 7714-2015相比,变更了哪些,对期刊参考文献格式有什么影响?
- 别被这个老掉牙的报纸理论版投稿邮箱误导了!最新核实91个报纸理论版投稿邮箱通道,一次集齐
- 喜报!《中国博物馆》入选CSSCI扩展版来源期刊(最新CSSCI南大核心期刊目录2025-2026版)!新入选!
- 2025年中科院分区表已公布!Scientific Reports降至三区
- 国内核心期刊分级情况概览及说明!本篇适用人群:需要发南核、北核、CSCD、科核、AMI、SCD、RCCSE期刊的学者
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



