沙棘原浆苹果酸-乳酸发酵过程中理化指标及抗氧化能力的变化
沙棘果实含有黄酮、酚类化合物、脂肪酸和维生素A、C、E等多种功效成分,具有很高的生物学价值[1]。作为纯天然的膳食补充剂,以新鲜的沙棘果实加工而成的沙棘原浆备受消费者欢迎。但沙棘果有机酸含量较高,其中以苹果酸和奎宁酸为主,约占总酸90%[2],原浆口感过于酸涩,无法直接饮用。
降低酸度是改善原浆口感的有效方法,目前应用于果汁的降酸方法包括物理降酸法、化学降酸法和生物降酸法。生物降酸法是利用微生物进行苹果酸-乳酸发酵(malolactic fermentation,MLF),MLF可将双羧基的苹果酸转化为单羧基的乳酸[3],从而降低总酸中苹果酸的含量,口味也会变得更加柔和圆润。该法因降酸效果明显,且有助于改善口感和风味,因此比其他方法更受欢迎[4]。具有苹果酸-乳酸转化能力的微生物主要为乳酸菌中的乳球菌属、乳杆菌属和片球菌属等,MLF用于葡萄酒后发酵的研究和应用已经较为广泛。近年来,将MLF应用于高苹果酸含量果汁的研究越来越多。其中酒酒球菌表现出更强的对低pH果汁的耐受性,其可通过MLF降低高酸度果汁北五味子和青梅汁中苹果酸含量,同时增强了果汁的抗氧化活性[5-6]。
目前,国内有关沙棘与其他果汁复合饮料的研究较多,将酒酒球菌应用于沙棘果酒也有报道。但对沙棘原浆的MLF尚未见深入研究。本试验以高酸度大果沙棘原浆为原料,接种酒酒球菌CICC 6066,测定发酵过程中有机酸、单糖、黄酮醇、酚酸含量和超氧化物歧化酶(superoxide dismutase,SOD)及抗氧化活性的动态变化,以明确酒酒球菌发酵对沙棘原浆理化指标、生物活性物质的含量及抗氧化能力等的影响,为高苹果酸含量原浆的利用提供参考。
1 材料与方法
1.1 材料与试剂
沙棘原浆,张北宝得康食品有限公司;酒酒球菌CICC 6066冻干粉,上海保藏生物技术中心。
ATB培养基,上海瑞楚生物科技有限公司;DPPH、三吡啶基三嗪(2,4,6-tripyridin-2-yl-1,3,5-triazine,TPTZ)、ABTS、没食子酸、柠檬酸、草酸、乳酸、DL-苹果酸、奎宁酸、槲皮素、山奈酚、异鼠李素、葡萄糖、果糖、蔗糖、山梨醇、鼠李糖,上海易恩化学技术有限公司;香豆素、咖啡酸、阿魏酸、儿茶酸、表儿茶酸,上海麦克林生化科技有限公司;上述所有药品均为分析纯;乙腈、甲醇、冰乙酸(均为色谱纯),抗坏血酸(分析纯),天津欧博凯化工有限公司。
1.2 仪器与设备
PB-21型pH计,赛多利斯科学仪器有限公司;KQ-50DA数控超声波清洗器,昆山市超声仪器有限公司;MultiSkan FC酶标仪,赛默飞世尔科技公司;ZHJH-C1214C垂直流超净工作台,上海智城分析仪器制造有限公司;C-2L-ARE旋转蒸发器,上海舍岩仪器有限公司;UV-2700紫外可见分光光度计、LC-20AT高效液相色谱仪,日本岛津公司。
1.3 试验方法
1.3.1 发酵种子液的制备
将酒酒球菌CICC 6066冻干粉用0.2 mL的溶解液溶解混合均匀,吸取100 μL接种到ATB斜面培养基中,25 ℃培养2 d,从斜面培养基中挑取1环接入ATB液体培养基中,25 ℃培养2 d,连续活化2次,将所得菌液离心(4 000 r/min,10 min),并用生理盐水洗涤2次后再次离心,弃去上清液,收集菌泥;用生理盐水重悬,调整细胞浓度为1×109 CFU/mL作为发酵种子液。
1.3.2 发酵沙棘原浆的制备
沙棘原浆初始pH为2.70,可溶性固形物为12.30%。用NaHCO3(1 mol/L)溶液调其pH至3.5,调酸后沙棘浆的色泽无明显变化,呈橙黄色。然后接种酒酒球菌CICC 6066种子发酵液,接种量为5%,使初始菌数达到1×107 CFU/mL。对接种后沙棘浆进行分装,每份100 mL分装于200 mL三角瓶中,置于25 ℃恒温培养箱发酵8 d,每2 d取样分析,并留样置-80 ℃冻存,备用。
1.3.3 微生物及理化指标的测定
活菌数的测定参照GB 4789.35—2016;pH值使用pH计直接测定;可溶性固形物含量的测定参照NY/T 2637—2014;总酸的测定参照GB/T 12456—2021;总糖的测定采用苯酚硫酸法[7]。
1.3.4 有机酸的测定
参照文献[8]的方法,稍作修改。色谱条件为色谱柱:InertSustain-C18(4.6 mm×250 mm,5 μm);流动相:0.05 mol/L KH2PO4溶液(pH 2.70);等度洗脱20 min;流速0.6 mL/min;紫外检测器,波长210 nm;柱温30 ℃;进样量20 μL。
准确称取草酸、抗坏血酸各0.10 g(精确至0.000 1 g),乳酸、奎宁酸各0.20 g,苹果酸、柠檬酸各0.40 g,流动相定容于100 mL容量瓶中,配制成质量浓度分别为1 000、1 000、2 000、2 000、4 000、4 000 mg/L的混合标准溶液。
精密移取10 mL沙棘汁至100 mL容量瓶,用流动相定容,然后用0.45 μm微孔滤膜过滤后直接进样。
1.3.5 糖和糖醇的测定
参照GB 5009.8—2016的方法。色谱柱:ZXBridge Amide(粒径3.5 μm,4.6 mm×250 mm);检测器为示差折光检测器;流动相为90%乙腈水(含0.1%氨水);流速1.0 mL/min;检测器温度40 ℃;柱温40 ℃;进样量10 μL。
分别称取果糖、葡萄糖、蔗糖、鼠李糖和山梨醇各1 g(精确至0.1 g),用水定容至50 mL容量瓶中,配制成质量浓度均为20 mg/mL的标准溶液。
准确移取1 mL发酵液到50 mL离心管,加入10 mL水后,再依次加入2 mL ZnSO4和2 mL亚铁氰化钾,涡旋1 min,用水定容到25 mL,10 000 r/min离心5 min后取上清液,0.45 μm微孔滤膜过滤后直接进样。
1.3.6 黄酮醇的测定
参照文献[9]的方法,略作修改。色谱柱:InertSustain-C18(4.6 mm×250 mm,5 μm);流动相:V(甲醇)∶V(0.4%磷酸水溶液)=50∶50;等度洗脱45 min;流速1.0 mL/min;紫外检测器,波长360 nm,柱温35 ℃,进样量20 μL。
精确称取槲皮素、山奈酚、异鼠李素各10 mg(精确至0.1 mg),用甲醇定容于100 mL容量瓶中,配制成质量浓度均为100 mg/L的标准溶液。
准确吸取发酵液2 mL于50 mL离心管中,加入10 mL甲醇振荡1 min,10 000 r/min离心10 min,取上清液,0.22 μm微孔滤膜过滤后直接进样。
1.3.7 酚酸的测定
参照文献[10]的方法,略作修改。色谱柱:InertSustain-C18(4.6 mm×250 mm,5 μm);流动相:A,V(蒸馏水)∶V(冰乙酸)=99∶1;B,V(蒸馏水)∶V(乙腈)∶V(冰乙酸)=67∶31∶1;流速1.0 mL/min;紫外检测器,波长280 nm,柱温30 ℃;进样量20 μL。梯度洗脱0 min,B:10%;0~10 min,B:20%;10~16 min,B:20%~40%;16~20 min,B:40%~50%;20~25 min,B:50%;16~30 min,B:70%;30~40 min,B:70%~10%;40~75 min,B:10%。
精确称取香豆素、儿茶酸、表儿茶酸、阿魏酸、咖啡酸、没食子酸、对羟基苯甲酸各10 mg(精确至0.1 mg),分别用甲醇定容于100 mL容量瓶中,配制成质量浓度均为100 mg/L的标准溶液。
样品处理参照文献[11]的方法,发酵浆中加入乙酸乙酯(体积比为1∶1),充分混匀,萃取3次,取上清液,然后于45 ℃旋转蒸发除去有机溶剂,蒸干后的剩余部分用4 mL甲醇溶解,溶解液经0.45 μm微孔滤膜过滤后直接进样。
1.3.8 SOD活力测定
发酵浆离心(8 000 r/min,10 min)后取上清液稀释10倍,参照GB/T 5009.171—2003和郭伟峰等[12]的方法测定。
1.3.9 抗氧化能力的测定
·OH清除能力的测定采用Fenton法;DPPH自由基和ABTS阳离子自由基清除能力的测定参照文献![]() 清除能力的测定和总抗氧化能力(ferric ion reducing antioxidant power,FRAP)测定参照文献[14]的方法。
清除能力的测定和总抗氧化能力(ferric ion reducing antioxidant power,FRAP)测定参照文献[14]的方法。
1.4 数据处理
所有数据用Excel 2010、SPSS 26.0软件进行方差分析和相关性分析。每个指标测定均重复3次,取平均值,结果以平均值±标准差表示。
2 结果与分析
2.1 沙棘原浆MLF过程中微生物及理化指标的变化
沙棘原浆发酵过程中微生物及主要理化指标变化如表1所示,沙棘浆的活菌数显著增加,发酵第6天达到最高(9.66 lg CFU/mL),沙棘浆pH从初始3.50持续升高,发酵第4天达到3.91,与发酵第8天(3.98)无显著性差异;而发酵过程中可溶性固形物、总酸和总糖的含量均显著降低,这与酒酒球菌以有机酸和糖作为碳源发酵利用有关。由于酸性条件下,酒酒球菌优先利用有机酸,因此总酸降低幅度较大。沙棘浆发酵后总酸降低59.61%,总糖降低19.08%,糖酸比从2.40增加到4.80。糖酸比的增加有助于沙棘原浆口感的改善。
表1 沙棘原浆发酵过程中微生物及理化指标的变化
Table 1 Changes in microbes and physical and chemical indexes of sea buckthorn puree during fermentation

注:同行小写字母不同表示组间存在显著性差异(P<0.05)(下同)
2.2 沙棘原浆MLF过程中有机酸含量的变化
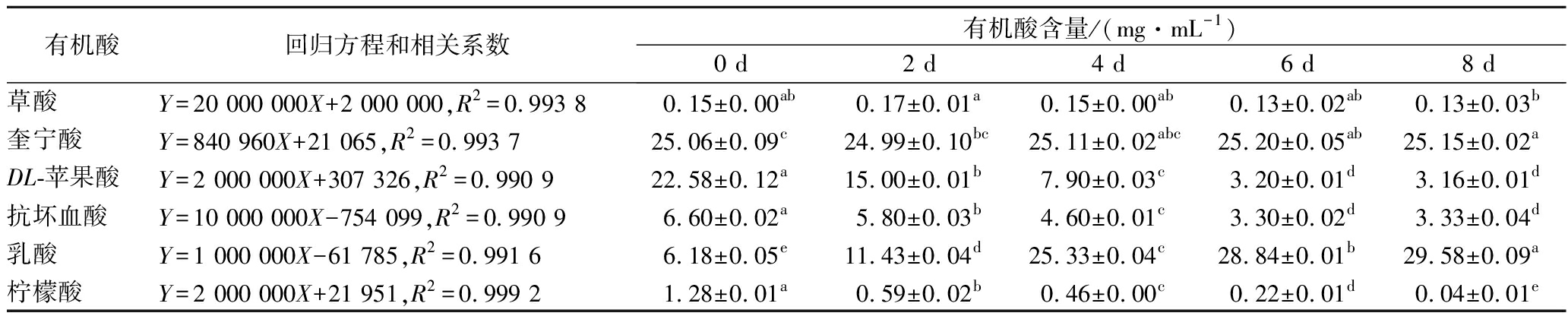
标准有机酸和发酵沙棘浆有机酸HPLC(分离详细色谱图见电子版增强附件图1和图2),对比可确定沙棘浆中含有草酸、奎宁酸、DL-苹果酸、抗坏血酸、乳酸和柠檬酸等6种有机酸。
发酵前后沙棘浆中有机酸含量的变化见表2。发酵前有机酸以DL-苹果酸和奎宁酸为主,发酵后有机酸比例发生了明显变化,以乳酸和奎宁酸为主。MLF发酵的重要标志是苹果酸转化为乳酸,发酵8 d后,沙棘原浆中苹果酸由22.58 mg/mL降低到3.16 mg/mL,苹果酸降解率达到86.01%;结果还显示发酵6 d,苹果酸含量为3.20 mg/mL,与发酵8 d无显著性差异,说明发酵6 d已达到了苹果酸降解的最高值;乳酸含量增加了3.79倍,达到29.58 mg/mL。表明酒酒球菌CICC 6066在此沙棘浆发酵过程中能够产生苹果酸乳酸酶,催化苹果酸转化为乳酸。张晟等[5]优化北五味子MLF后苹果酸降解率达到了59%。本研究计划下一步优化发酵工艺,以进一步提高苹果酸降解率。
同时,由表2还可看出柠檬酸含量也有所降低,何翠婵等[6]用酒酒球菌发酵青梅汁,也证实该菌可利用柠檬酸作为碳源。另外,发酵后抗坏血酸含量降低,主要原因可能是抗坏血酸属于烯醇化合物,化学性质极不稳定,容易发生氧化反应形成醌类物质,洪冰[15]和郝媛等[16]的研究也得出相同的结论。发酵前后,沙棘原浆中奎宁酸和草酸没有显著变化。
表2 沙棘原浆发酵过程中有机酸含量的变化
Table 2 Changes in organic acids of sea buckthorn puree during fermentation
2.3 沙棘原浆MLF过程中糖的变化
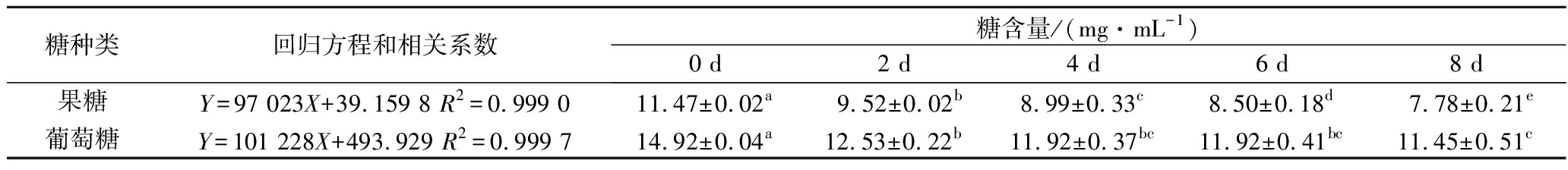
标准糖和发酵沙棘浆糖HPLC分离详细色谱图见电子版增强附件图3和图4,通过比对可确定沙棘浆中含有葡萄糖和果糖2种单糖。
TKACZ等[1]从试验所用沙棘汁中检测出葡萄糖、果糖、蔗糖、鼠李糖和山梨醇等5种糖和糖醇,而本试验从大果沙棘原浆中仅检测出葡萄糖和果糖2种单糖(表3),所含糖的种类和数量不同可能与沙棘品种有关。发酵过程中,2种单糖含量均显著减少;发酵第8天,葡萄糖和果糖分别降低了23.25%和32.17%;表明酒酒球菌具有一定的利用还原糖作为碳源的能力,何翠婵等[6]研究也发现酒酒球菌在添加了葡萄糖的青梅汁中,生长速率显著加快,葡萄糖对其生长有促进作用。另外,葡萄糖的含量在发酵4 d时为11.92 mg/mL,此后并无显著性降低,果糖的降解速度在4 d后显著变缓慢,说明这2种糖在酒酒球菌进入指数生长期后(4 d)降解速率均减慢。
表3 沙棘原浆发酵过程中糖的变化
Table 3 Changes in monosaccharides of sea buckthorn puree during fermentation
2.4 沙棘原浆MLF过程中黄酮醇和酚酸的变化
标准黄酮醇、酚酸和发酵沙棘浆黄酮醇、酚酸HPLC分离详细色谱图见电子版增强附件图5~图8,通过对比可确定沙棘中有槲皮素、山奈酚和异鼠李素3种黄酮醇和没食子酸、对羟基苯甲酸、儿茶酸、咖啡酸、表儿茶酸、阿魏酸、香豆素等7种酚酸。
采用高效液相色谱法测定了沙棘原浆发酵过程中黄酮醇和酚酸的变化,见表4。沙棘原浆中黄酮醇以异鼠李素为主,占比56.37%。发酵后各黄酮醇的含量均显著增加,发酵第8天,总黄酮醇(3.913 mg/L)较原汁增加了49.35%,可能是部分黄酮类物质与不溶性膳食纤维结合,酒酒球菌发酵过程中产生的酶,使这部分黄酮释放为水溶性黄酮苷,导致各黄酮醇含量的增加[17]。
表4 沙棘原浆发酵过程中黄酮醇和酚酸含量的变化
Table 4 Changes in flavonols and phenolic acids of sea buckthorn puree during fermentation
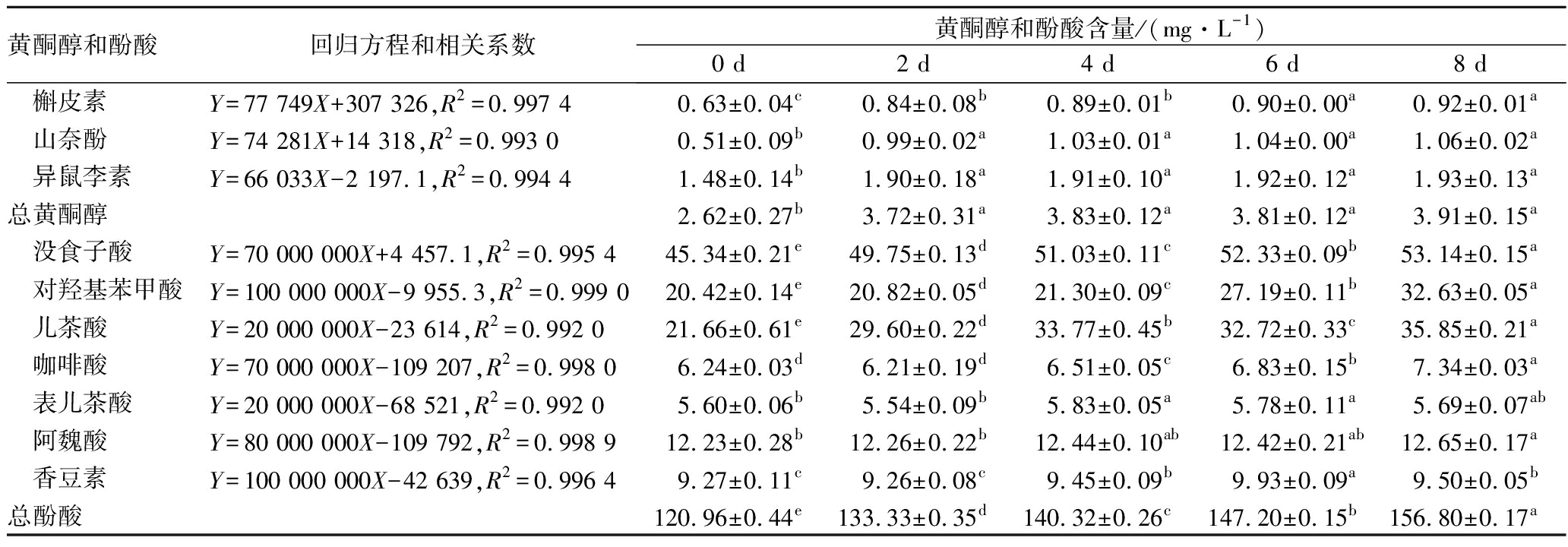
除表儿茶酸外,各酚酸也均呈显著增加的趋势。发酵8 d后,总酚酸含量达到156.78 mg/L,较原浆增加了29.63%;酚酸含量最高的仍为没食子酸,占比33.89%,对羟基苯甲酸和儿茶酸各增加了59.80%和65.50%。总的来说,可能是由于酚类化合物进行了去糖基化反应,植物细胞壁上释放出了可溶性共轭或不溶性的酚类化合物,使得酚酸的含量增高[18]。
2.6 沙棘原浆MLF过程中SOD活力变化
乳酸菌发酵可产生一些功能性酶类,如SOD。作为一种体内![]() 的天然清除剂,SOD活性已成为评价保健食品抗衰老的重要指标[19]。由图1可知,沙棘原浆随着发酵的进行,SOD活力显著增加,第8天酶活力达到4 454.54 U/mL,为未发酵沙棘原浆的8.06倍。
的天然清除剂,SOD活性已成为评价保健食品抗衰老的重要指标[19]。由图1可知,沙棘原浆随着发酵的进行,SOD活力显著增加,第8天酶活力达到4 454.54 U/mL,为未发酵沙棘原浆的8.06倍。
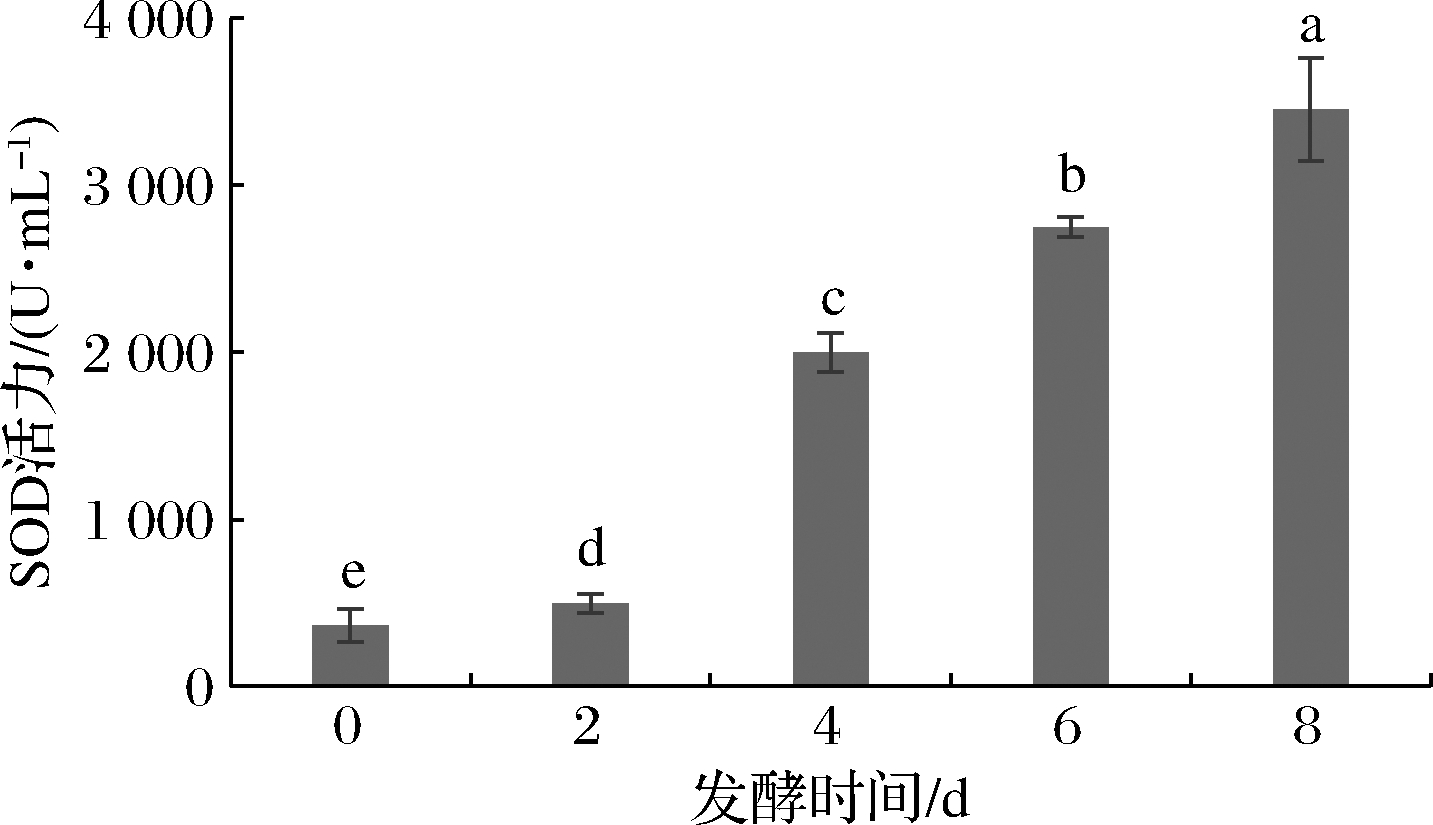
图1 沙棘原浆发酵过程中SOD活力变化
Fig.1 Activity of SOD in sea buckthorn puree during fermentation
郭伟峰等[12]以SOD活力为指标,优化桑葚酵素的发酵工艺后SOD活力提高了123%,可达24 122.2 U/mL。表明乳酸菌发酵能显著提高果汁的SOD活力。
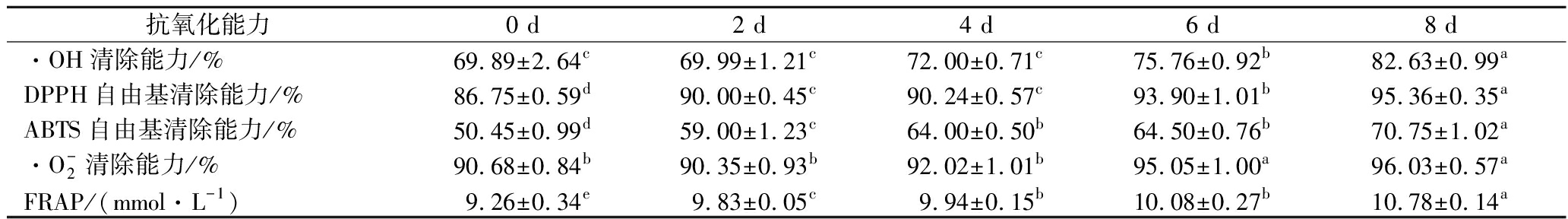
2.7 沙棘原浆MLF过程中抗氧化能力的变化
过量超氧化物自由基的存在会加速机体的氧化衰老,因此清除自由基的能力常被作为评价食品抗氧化活性的指标[20]。由表5可知,发酵后,沙棘汁的各抗氧化指标均显著增强(P>0.05),发酵第8天后分别较未发酵原汁提高了18.22%、9.92%、40.23%、5.90%和16.41%。表明酒酒球菌发酵沙棘浆可提高其抗氧化能力,这与发酵后沙棘浆黄酮醇、酚酸等天然抗氧化物质含量显著增加有直接关系,相关性分析表明,总酚酸和DPPH,ABTS及FRAP之间显著正相关,Pearson相关系数分别为0.977,0.984和0.905。
表5 沙棘原浆发酵过程中各抗氧化能力的变化
Table 5 Changes in antioxidant capacity of sea buckthorn puree during fermentation
3 结论
本研究利用酒酒球菌CICC 6066发酵沙棘原浆,该菌在沙棘原浆中生长能力较强,发酵4 d菌数达到9.59 lg CFU/mL,且表现出较好的苹果酸-乳酸转化能力,使沙棘浆中苹果酸降解86.01%,乳酸占比由9.86%增加到49.75%,pH值升高了0.48;同时,酒酒球菌还可利用葡萄糖和果糖作为碳源,但利用有机酸能力更强,发酵后糖酸比提高了2.50。发酵沙棘浆的黄酮醇和酚酸分别比未发酵沙棘原浆增加了49.35%和29.63%,总量达到160.71 mg/L;由于抗氧化物质含量的增加,发酵沙棘浆的SOD活力及体外抗氧化活性均显著性提高。本研究还表明,发酵第6天苹果酸降解率达到最大值,研究结果为进一步优化高酸度果浆的MLF工艺提供了参考。
- GB/T 7714-2025与GB/T 7714-2015相比,变更了哪些,对期刊参考文献格式有什么影响?
- 别被这个老掉牙的报纸理论版投稿邮箱误导了!最新核实91个报纸理论版投稿邮箱通道,一次集齐
- 喜报!《中国博物馆》入选CSSCI扩展版来源期刊(最新CSSCI南大核心期刊目录2025-2026版)!新入选!
- 2025年中科院分区表已公布!Scientific Reports降至三区
- 国内核心期刊分级情况概览及说明!本篇适用人群:需要发南核、北核、CSCD、科核、AMI、SCD、RCCSE期刊的学者
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



