离子液体萃取硝酸中Ce(Ⅳ)的动力学研究
引言
离子液体是由阴阳离子构成,在室温下呈液态的有机盐类化合物。以离子液体为溶剂的萃取体系对核电站乏燃料水法后处理中关键核素通常表现出更高的萃取效率和选择性,但其萃取行为和机理通常更为复杂[1-4]。同时,由于离子液体的阴离子通常具有一定亲水性,因此离子液体在溶剂萃取过程中不仅作为溶剂,也可以通过阴离子交换萃取水相中以配阴离子或含氧酸根形式存在的金属离子,如Pu(Ⅳ)[4]、Ce(Ⅳ)[5-6]、Tc(Ⅶ)[7]等。因此在离子液体体系萃取水相阴离子组分的研究中,需考虑离子液体自身的萃取行为,否则实验结果的解释可能偏离实际。Rout等[8-9]提出对离子液体/有机分子溶剂体系的研究,有利于理解离子液体体系的萃取行为及萃取机理;该思路也已被应用于研究离子液体和萃取剂间的协同萃取行为[10-11]。Li等[6]将1-丁基-3甲基咪唑双三氟甲磺酰亚胺盐(C4mimNTf2)溶解于1,2-二氯乙烷中,考察了其萃取硝酸中Ce(Ⅳ)的行为和机理,结果表明C4mimNTf2更倾向于通过阴离子交换萃取单价组分
由于具有相近的离子半径和配位结构,Ce(Ⅳ)通常作为Pu(Ⅳ)的非放射性替代元素研究其萃取行为[20]。同时,由于离子液体C4mimNTf2具有较高的化学和辐照稳定性,以及相对较低的黏度,在离子液体萃取体系中应用较为广泛。因此,本文通过恒界面池法,以1,2-二氯乙烷为有机相稀释剂,研究C4mimNTf2对硝酸介质中Ce(Ⅳ)的萃取动力学,并考察有机相中萃取剂TBP对体系萃取动力学的影响;同时结合分子动力学模拟研究萃取体系相界面的结构及特征。
1 研究方法
1.1 实验试剂
若无额外说明,实验药品均为分析纯试剂且均未经任何预处理。其中,C4mimNTf2购买于林州科能有限公司,> 99.0%;1,2-二氯乙烷购于麦克林公司,为色谱纯试剂,> 99.7%;TBP购于麦克林公司,为分析纯试剂;硝酸钠购于天津福晨化学试剂有限公司,为分析纯试剂;水相Ce(Ⅳ)溶液由硝酸铈铵晶体(麦克林,分析纯)溶于硝酸溶液(大茂,分析纯)制成。实验用水均为实验室自制一级去离子水。
1.2 萃取动力学实验及数据处理
恒界面池装置由中国原子能研究院设计并加工[21],恒界面池结构及参数在图1中给出。实验前,两相料液分别水浴加热至预定温度。实验中,按一定时间间隔取水相料液测定Ce(Ⅳ)浓度。水相 Ce(Ⅳ)浓度通过分光光度法测定[22]。若无说明,所有萃取动力学实验均在25℃下进行,水相Ce(Ⅳ)浓度为7.0 mmol·L-1,水相硝酸浓度为3.0 mol·L-1,有机相C4mimNTf2浓度为0.5 mol·L-1,两相体积均为15 ml,相界面面积为10.4 cm2。
图1
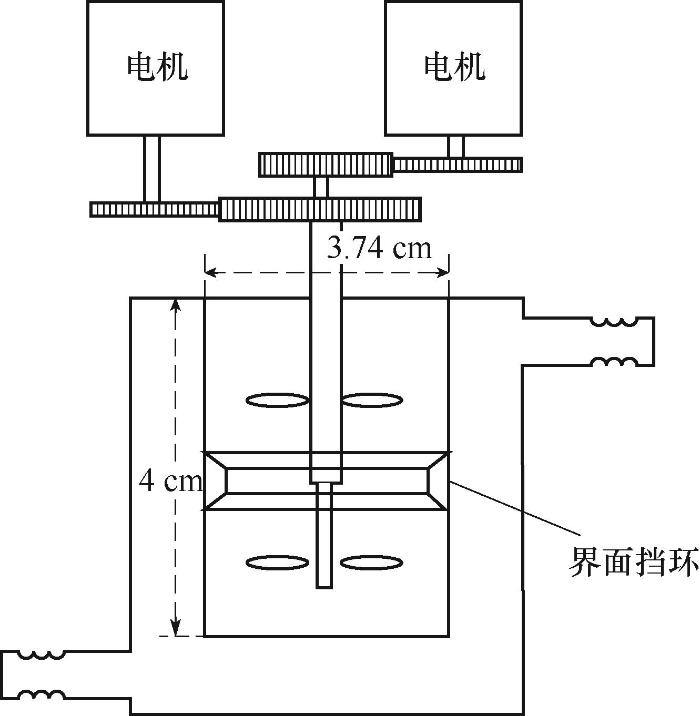
图1 恒界面池装置
Fig.1 Diagram of constant interfacial area cell
萃取动力学数据通过微分法处理。初始萃取速率为:
式中,k为表观速率常数;A为相界面面积;V为水相体积;a、b为反应级数;下角标0表示初始时刻。实验数据通过五次函数拟合,r0为t = 0时刻的一阶导数值。
1.3 分子动力学模拟
通过分子动力学模拟研究C4mimNTf2 + 1,2-二氯乙烷 / H2O + HNO3体系的相界面性质。为考虑水相硝酸形态的影响,模拟设定50%硝酸以HNO3分子形式存在,50%硝酸电离成H3O+和
通过Packmol程序[34]构建初始体系结构,如图2所示:水相中水分子个数为8000,硝酸分子、H3O+和
图2

图2 萃取两相体系示意图
Fig.2 Snapshot of the two phases system
2 结果与讨论
2.1 萃取动力学模式的判定
在恒界面池法的萃取动力学研究中,一般通过综合分析搅拌转速n、比界面面积α(α = A/V)及温度T对萃取速率r0的影响判定萃取动力学模式。实验分别测定水相及有机相中搅拌转速对Ce(Ⅳ)萃取速率的影响,如图3(a)所示。实验表明,萃取速率随水相中搅拌速率的增加而缓慢增加,但由于1,2-二氯乙烷黏度与水相近,当水相搅拌速率超过约95 r·min-1时,两相界面出现扰动,萃取速率突增;而在有机相中所考察的搅拌速率范围内,萃取速率基本维持恒定。由此可初步认为萃取过程为扩散模式或者动力学模式,主要阻力均存在于水相中。在后续实验中,两相内搅拌速率均设定为80 r·min-1。
图3

图3 萃取模式判定
Fig.3 Determination of extraction control mode
图3(b)表明Ce(Ⅳ)的萃取速率r0随两相界面面积A增加而增加,二者间呈正比关系且经过原点,因此该萃取过程受界面过程影响,即萃取过程为界面化学反应控制过程[40]。
为进一步说明体系的萃取动力学模式,实验测定了20~40℃范围内萃取速率随温度的变化。图3(c)给出了lnr0关于1/T的斜率。根据Arrhenius方程拟合反应活化能:
式中,Ea为活化能;R为摩尔气体常数;T为温度;C为常数。通常而言,化学反应相较于扩散对温度变化更为敏感,化学反应活化能通常大于42 kJ·mol-1,而扩散过程一般不超过21 kJ·mol-1[41]。拟合得到的活化能为29.9 kJ·mol-1,位于二者之间。
综上所述,可以初步判断C4mimNTf2萃取硝酸介质中的Ce(Ⅳ)是由水相扩散以及界面反应共同控制的“混合模式”。
2.2 两相组成对萃取速率的影响
2.2.1 硝酸浓度影响
在硝酸溶液中,Ce4+与硝酸根通过逐级配位生成系列配合物,Ce(Ⅳ)的物种分布与硝酸浓度密切相关。同时由于阴离子交换萃取机理,C4mimNTf2仅萃取水相中的阴离子组分,因此,水相硝酸浓度对Ce(Ⅳ)的萃取有明显影响。不同硝酸浓度下Ce(Ⅳ)的萃取速率在图4中给出。硝酸浓度低于2 mol·L-1时,Ce(Ⅳ)萃取速率较低且几乎不随硝酸浓度增加而改变;随硝酸浓度继续增加,Ce(Ⅳ)萃取速率增加;当硝酸浓度高于5 mol·L-1时,Ce(Ⅳ)萃取速率几乎不变。
图4

图4 水相硝酸浓度对萃取速率的影响
Fig.4 Dependence of extraction rate on initial aqueous nitric acid concentration
分配比实验表明,C4mimNTf2 + 1,2-二氯乙烷体系倾向于萃取硝酸溶液中
为进一步说明硝酸浓度影响的本质,分别固定水相
图5

图5 水相氢离子浓度对萃取速率的影响(水相硝酸根浓度c(
Fig.5 Dependence of extraction rate on aqueous hydrogen ion concentration with 3.0 mol·L-1 aqueous nitrate ion
图6

图6 水相硝酸根浓度对萃取速率的影响(水相氢离子浓度c(H+) = 3.0 mol·L-1)
Fig.6 Dependence of extraction rate on aqueous nitrate ion concentration with 3.0 mol·L-1 aqueous hydrogen ion
而固定水相氢离子浓度为3.0 mol·L-1,Ce(Ⅳ)萃取速率随水相
2.2.2 Ce(Ⅳ)浓度影响
水相初始Ce(Ⅳ)浓度对萃取速率的影响在图7中给出。如图所示,Ce(Ⅳ)的萃取速率随Ce(Ⅳ)浓度增加而增加,且lgc[Ce(Ⅳ)]和lgr0呈良好的线性关系,斜率为1.18,因此可认为 Ce(Ⅳ)的萃取速率与水相Ce(Ⅳ)浓度为一级关系。
图7

图7 水相Ce(Ⅳ)浓度对萃取速率的影响
Fig.7 Dependence of extraction rate on aqueous Ce(Ⅳ) concentration
2.2.3 离子液体浓度影响
图8为恒定水相组成的条件下,Ce(Ⅳ)萃取速率与有机相C4mimNTf2浓度的变化关系。萃取速率随C4mimNTf2浓度增加而增加,且lgc(C4mimNTf2)和lgr0呈直线关系,斜率为0.98,因此可认为Ce(Ⅳ)的萃取速率与C4mimNTf2浓度为一级关系。
图8

图8 有机相C4mimNTf2浓度对萃取速率的影响
Fig.8 Dependence of extraction rate on organic C4mimNTf2 concentration
综上所述,在25℃,水相硝酸浓度为3.0 mol·L-1时,C4mimNTf2萃取Ce(Ⅳ)的初始萃取速率方程可写为:
通过拟合实验数据,表观速率常数k为0.094 L·cm·mol-1·min-1。
2.2.4 水相NTf−2
由于萃取体系的阴离子交换机理,
图9

图9 水相
Fig.9 Dependence of extraction rate on aqueous
2.2.5 有机相TBP的影响
在实际中,离子液体萃取体系的有机相通常为萃取剂和离子液体混合溶液,因此,萃取剂和离子液体混合物对水相组分萃取行为的研究更具应用价值,同时对理解离子液体萃取体系的机理具有重要意义。研究表明,硝酸溶液中Ce(Ⅳ)的动力学过程在TBP体系中主要为扩散控制[43],与C4mimNTf2体系间存在一定差异。
萃取热力学实验表明,由于有机相中TBP和C4mimNTf2通过P
式中,n为溶液中对应组分物质的量。实验中固定有机相中TBP和C4mimNTf2总浓度为0.5 mol·L-1,改变二者摩尔比,结果在图10中给出。当有机相中TBP摩尔分数为1时,即有机相中不含C4mimNTf2,Ce(Ⅳ)的萃取速率为0.80 mmol·L-1·min-1,其显著大于相同浓度C4mimNTf2萃取Ce(Ⅳ)的速率0.30 mmol·L-1·min-1。
图10

图10 TBP摩尔分数对萃取速率的影响(TBP和C4mimNTf2总浓度为0.5 mol·L-1)
Fig.10 Dependence of extraction rate on the molar fraction of TBP with total concentration of TBP and C4mimNTf2 at 0.5 mol·L-1
Ce(Ⅳ)萃取速率与TBP摩尔分数间的下凹曲线关系,说明TBP和C4mimNTf2间存在动力学的反协同效应。其主要原因同样是由于有机相中TBP和咪唑阳离子间通过氢键形成复合物,复合物需要解离生成自由TBP,通过P
2.3 萃取体系界面的分子动力学模拟
C4mimNTf2萃取硝酸溶液中Ce(Ⅳ)的动力学实验研究表明,体系相界面行为是影响萃取动力学的重要因素之一。因此通过分子动力学模拟相平衡状态下的两相溶液,从微观层面理解萃取体系的相界面行为和性质。
2.3.1 C4mimNTf2 + 1,2-二氯乙烷体系
通过分子动力学模拟研究体系中各组分沿z轴方向在两相中的分布。对于水相-有机相界面,使用“90-90”标准定义界面区域[44],即为水和1,2-二氯乙烷在相主体浓度均为90%之间的区域,相界面区域在图11(a)中以阴影部分表示。如图11(a)所示,C4mim+和
图11

图11 C4mim+和
Fig.11 Number and charge density profile of C4mim+ and
如图12所示,C4mim+和
图12

图12 C4mim+和
Fig.12 Center of mass radial distribution function between C4mim+ and
综上所述,结合萃取动力学实验及分子动力学模拟,可以认为C4mimNTf2萃取硝酸介质中Ce(Ⅳ)主要包括以下步骤:(1)Ce(Ⅳ)在硝酸溶液水相中生成可萃的阴离子
2.3.2 C4mimNTf2 + TBP + 1,2-二氯乙烷体系
当有机相中加入TBP后,如图12所示,C4mim+和
图13

图13 P
Fig.13 Radial distribution function between the oxygen atom in P
图14给出体系中C4mim+、
图14

图14 C4mim+、
Fig.14 Diffusion coefficient of C4mim+,
3 结 论
结合恒界面池法和分子动力学模拟研究了C4mimNTf2萃取硝酸介质中Ce(Ⅳ)的动力学,结果表明:
(1)C4mimNTf2存在明显的界面吸附行为,在实验条件下,萃取过程为扩散-界面化学反应共同控制的动力学模式,扩散阻力主要存在于水相中,萃取过程的表观速率常数为0.094 L·cm·mol-1·min-1;
(2)萃取体系中,C4mimNTf2存在明显的界面吸附行为,Ce(Ⅳ)配阴离子在界面附近与C4mimNTf2发生阴离子交换,并进一步转移至有机相;
(3)有机相中引入TBP后,TBP与C4mimNTf2间通过氢键作用结合,同时溶液中各组分扩散系数降低,使TBP和C4mimNTf2间表现为动力学的反协同萃取效应。
- GB/T 7714-2025与GB/T 7714-2015相比,变更了哪些,对期刊参考文献格式有什么影响?
- 别被这个老掉牙的报纸理论版投稿邮箱误导了!最新核实91个报纸理论版投稿邮箱通道,一次集齐
- 喜报!《中国博物馆》入选CSSCI扩展版来源期刊(最新CSSCI南大核心期刊目录2025-2026版)!新入选!
- 2025年中科院分区表已公布!Scientific Reports降至三区
- 国内核心期刊分级情况概览及说明!本篇适用人群:需要发南核、北核、CSCD、科核、AMI、SCD、RCCSE期刊的学者
- CSSCI官方早就公布了最新南核目录,有心的人已经拿到并且投入使用!附南核目录新增期刊!
- 北大核心期刊目录换届,我们应该熟知的10个知识点。
- 注意,最新期刊论文格式标准已发布,论文写作规则发生重大变化!文字版GB/T 7713.2—2022 学术论文编写规则
- 盘点那些评职称超管用的资源,1,3和5已经“绝种”了
- 职称话题| 为什么党校更认可省市级党报?是否有什么说据?还有哪些机构认可党报?

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



